譯者小結
蝦紅素是一種天然紅色類胡蘿蔔素,具有強大的抗氧化、抗炎和抗凋亡活性,廣泛存在於海洋生物中,因其分子結構能在細胞膜內外清除活性氧(ROS)。
研究顯示蝦紅素對多種眼疾(如老年性黃斑變性、青光眼、白內障、乾眼症和眼疲勞)有效,通過調節氧化應激和炎症途徑,改善視網膜功能、減少細胞凋亡並穩定眼表。
摘要
蝦紅素是一種天然存在的紅色類胡蘿蔔素色素,屬於葉黃素家族,通常在海洋環境中發現,特別是在微藻和海鮮如鮭魚、蝦和龍蝦中。由於其獨特的分子結構,蝦紅素具有一些重要的生物特性,主要表現為強大的抗氧化、抗炎和抗凋亡活性。越來越多的證據表明,蝦紅素在預防和治療多種眼科疾病(從眼前段到眼後段)中有效。因此,本綜述旨在全面評估蝦紅素在眼科疾病管理中的當前臨床應用。大量動物和人體研究報告了這種類胡蘿蔔素在視網膜疾病、眼表疾病、葡萄膜炎、白內障和眼疲勞等環境中的功效,這些研究突顯了其調節多種代謝途徑的能力,隨後恢復細胞穩態平衡。為了最大化其多靶點治療效果,需要進一步的長期臨床試驗,以確定適當的劑量、給藥途徑和最終產品的確切成分。
關鍵詞:蝦紅素;類胡蘿蔔素;眼睛;老年性黃斑變性;青光眼;白內障;乾眼症;氧化應激;營養補充劑
引言
蝦紅素(3,3′-二羥基-β,β-胡蘿蔔素-4,4′-二酮;摩爾質量596.84克/摩爾)是一種天然存在的類胡蘿蔔素,其結構和功能特性使其成為預防多種人類疾病以及維持良好健康狀態的潛在生物活性化合物[1]。它屬於葉黃素家族(類胡蘿蔔素的氧化衍生物),在海洋環境中尤為常見,看起來像紅色色素。這使得鮭魚、蝦、龍蝦和螯蝦的肉呈現粉紅色至紅色[2]。蝦紅素由浮游植物和微藻(如雨生紅球藻、綠球藻和葉黃素酵母)生物合成後,會在各種水生動物中積累,這些動物是這種寶貴營養素的主要飲食來源。作為葉黃素的一員,它由兩個末端環通過多烯鏈連接,並且在β-紫羅蘭酮環的3,3’位置有兩個不對稱碳原子,帶有羥基(-OH),賦予其親脂性和親水性。每個雙鍵多烯鏈可以以順式或反式幾何異構體存在。此外,由於3,3’位置的兩個立體中心碳原子的存在,蝦紅素有三種不同的立體異構體,包括一對對映異構體(3R,3’R-和3S,3’S-蝦紅素)和一個光學上無活性的中間型(3R,3’S-蝦紅素),如圖1所示[1]。
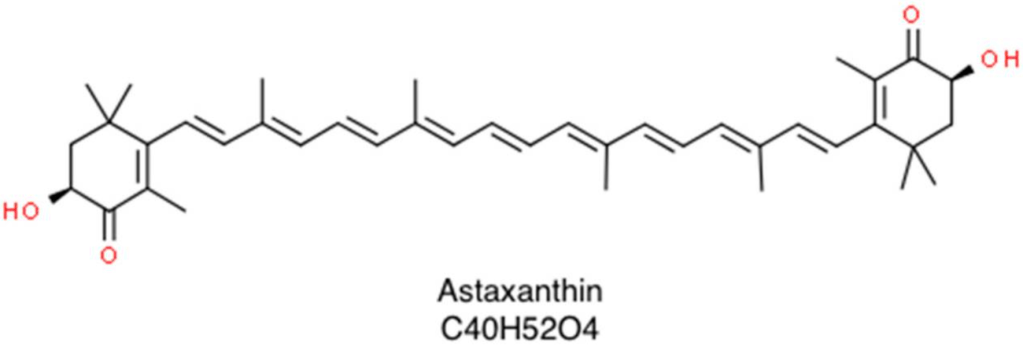
蝦紅素的應用領域從食品著色工業(因其天然鮮豔的紅色光澤)到水產養殖和家禽工業(因其天然飼料添加特性)不等[3]。此外,近年來在醫療領域使用蝦紅素以改善健康狀況引起了人們的興趣。不僅如此,它還顯示出多種有益效果,包括抗癌、抗糖尿病、抗炎和抗氧化活性,以及對皮膚、神經和心血管系統的保護作用[1,4,5]。目前,全球市場上95%的蝦紅素是使用石油化工合成生產的,因為這種方式在大規模生產中成本效益高;然而,最近對天然來源色素的興趣正在大幅增加[6,7]。
與大多數僅在膜內(如維生素E和β-胡蘿蔔素)或膜外(如維生素C)起作用的抗氧化劑不同,蝦紅素能夠穿過雙層膜,提供對氧化應激的保護,通過清除細胞膜內外層的活性氧(ROS)來實現[4,5]。
多項近期臨床試驗突顯了蝦紅素在促進眼部健康方面的潛在作用,這一點從多種眼科疾病(如糖尿病視網膜病變、老年性黃斑變性、青光眼和白內障)的結果顯著改善中可以看出。
本文旨在全面回顧蝦紅素在治療廣泛眼科疾病中的當前臨床應用。
文獻回顧:方法
使用PubMed、Scopus和Medline數據庫搜索截至2020年3月發表的相關文章,並通過已識別出版物的參考文獻進行補充。搜索詞包括以下關鍵短語:蝦紅素;類胡蘿蔔素;眼睛;老年性黃斑變性;青光眼;白內障;乾眼症;氧化應激;營養補充劑。
作用機制
抗氧化活性
氧化應激是由細胞內促氧化與抗氧化反應的微妙平衡被打破所引起的,是多種人類疾病發病機制的關鍵介質。事實上,過量的氧化劑可能與蛋白質、脂質和核酸發生連鎖反應,隨後導致功能和結構損傷。一般的類胡蘿蔔素通過中斷自由基連鎖反應或與其反應生成無害產物來發揮抗氧化活性,而蝦紅素則通過中和單線態氧並清除自由基來防止連鎖反應,從而保護膜結構[5]。Naguib及其合作者顯示,蝦紅素的抗氧化活性高於其他類胡蘿蔔素,如α-胡蘿蔔素、番茄紅素、葉黃素和β-胡蘿蔔素[8]。此外,另一項研究評估了蝦紅素、玉米黃質、葉黃素、β-胡蘿蔔素和番茄紅素對脂質過氧化的影響[9]。非極性類胡蘿蔔素番茄紅素和β-胡蘿蔔素使膜雙層紊亂並刺激膜脂質過氧化,而蝦紅素則保持膜結構並表現出顯著的抗氧化活性[9,10]。由於其分子排列,蝦紅素能夠結合並跨越細胞膜,隨後在中性(疏水)和極性(親水)邊界區中和自由基[4,10]。臨床上,這種生物活性化合物的抗氧化效能已被多項研究證實,這些研究報告氧化標記物(如丙二醛(MDA)和異前列腺素)的水平顯著降低,而抗氧化劑(如超氧化物歧化酶(SOD))的水平增加[11-13]。通過恢復促氧化與抗氧化劑之間的平衡,蝦紅素解決了影響眼部前段和後段的各種眼科疾病的主要特徵,這些疾病由促氧化環境驅動。光線穿透眼睛的每一層,產生大量ROS,而後天因素如持續高血糖、眼壓升高和炎症刺激加速氧化反應。因此,可能發生細胞死亡或細胞功能障礙,導致角膜病變、白內障形成和視網膜病變。由於蝦紅素有效防止ROS形成並對羥自由基具有高清除活性,預計使用這種葉黃素微量營養素治療可以阻止ROS相關疾病的發病和進展,這一點已通過減少視網膜神經節細胞死亡和增強眼表單位的穩定性得到證明[14-16]。
抗發炎活性
炎症與氧化應激構成了一個雙向關係的組成部分。炎症介質如白介素(IL)-1B、IL-6、IL-8和TNF-α在許多眼科疾病中上調,增加了ROS的表達,而ROS同樣導致炎症細胞因子、趨化因子和基質重塑因子的分泌增加,從而改變局部環境穩態,最終促成慢性炎症和氧化應激的惡性循環。雖然在感染或外部損傷的情況下迅速的炎症反應在某種程度上是適應性的,但過多的炎症介質產生可能導致細胞損傷、病理性新生血管化和隨後的功能障礙。在與炎症相關的眼科疾病中,免疫反應的若干效應器被內源性細胞內外危險信號激活,引發炎症級聯反應。例如,視網膜色素上皮(RPE)細胞的退行性變化觸發了一個惡性循環,促進視網膜和脈絡膜中慢性炎症和氧化應激的發展。持續的眼表壓力,包括淚液高滲透壓、淚液量和/或質量的變化以及紫外線暴露,也促成整個眼表的炎症參與。因此,在患有角膜或視網膜疾病的患者的淚液和房水中記錄到細胞因子水平升高[17,18]。炎症生物標記物還可以指導治療,因為針對炎症的療法比單純的症狀療法更有效地阻止慢性眼病的惡性循環。據報導,蝦紅素可以通過抑制細胞內ROS積累來抑制H₂O₂誘導的NF-κB激活。事實上,氧化劑水平的增加可能通過增強其抑制劑IκB的快速降解來增強NF-κB激活,從而允許轉錄因子NF-κB的核轉位並隨後表達若干炎症介質,包括iNOS、COX-2、TNF-α和IL-1β[19]。此外,如Macedo及其合作者報導,蝦紅素顯著改善中性粒細胞的吞噬和殺菌能力,主要通過減少氧化應激的有害影響並增加細胞內鈣濃度[20]。事實上,由於免疫細胞膜中含有高含量的多不飽和脂肪酸,它們對脂質過氧化過程特別敏感,並且由於重要的代謝活性通常產生更多的氧化劑[21]。作為這種免疫調節效果的證實,年輕健康女性在蝦紅素膳食補充後顯示出增強的細胞介導和體液免疫反應,而在治療後幽門螺桿菌感染的小鼠中記錄到細菌負荷和胃部炎症減少[22,23]。
抗凋亡活性
凋亡是一種程序性細胞死亡形式,在哺乳動物發育和組織穩態中起著關鍵作用。由於這種重要的生物活性,凋亡在多種與年齡相關的人類疾病(如神經退行性疾病、缺血性中風和心臟病)中作為關鍵致病因素[24]。蝦紅素根據病理狀況表現出抗凋亡或促凋亡效果。事實上,蝦紅素已被證明通過線粒體依賴性途徑誘導癌細胞凋亡[25]。另一方面,蝦紅素已被證明顯著減少視網膜神經節細胞凋亡,這是青光眼和其他視神經病變中視網膜損傷進展的負責因素,以及RPE細胞死亡,這是AMD發展的原因[26,27]。特別是,它被證明通過調節絲裂原活化蛋白激酶/p38(p38 MAPK)以及刺激PI3K/AKT存活途徑,增強BAD的磷酸化、下調細胞色素c和激活胱天蛋白酶3和9,從而減少線粒體相關凋亡[5,26,28,29]。因此,上述細胞死亡調節機制可能積極有助於改善早期腦損傷以及減少小鼠蛛網膜下腔出血和糖尿病視網膜病變模型中的視網膜神經節細胞損失[26,30]。支持眼部健康的臨床試驗(包括人類和實驗性試驗)顯示,蝦紅素改善了從眼部前段到後段的各種眼科疾病的結果。這種營養素的潛在臨床應用將在下文討論。
眼科應用
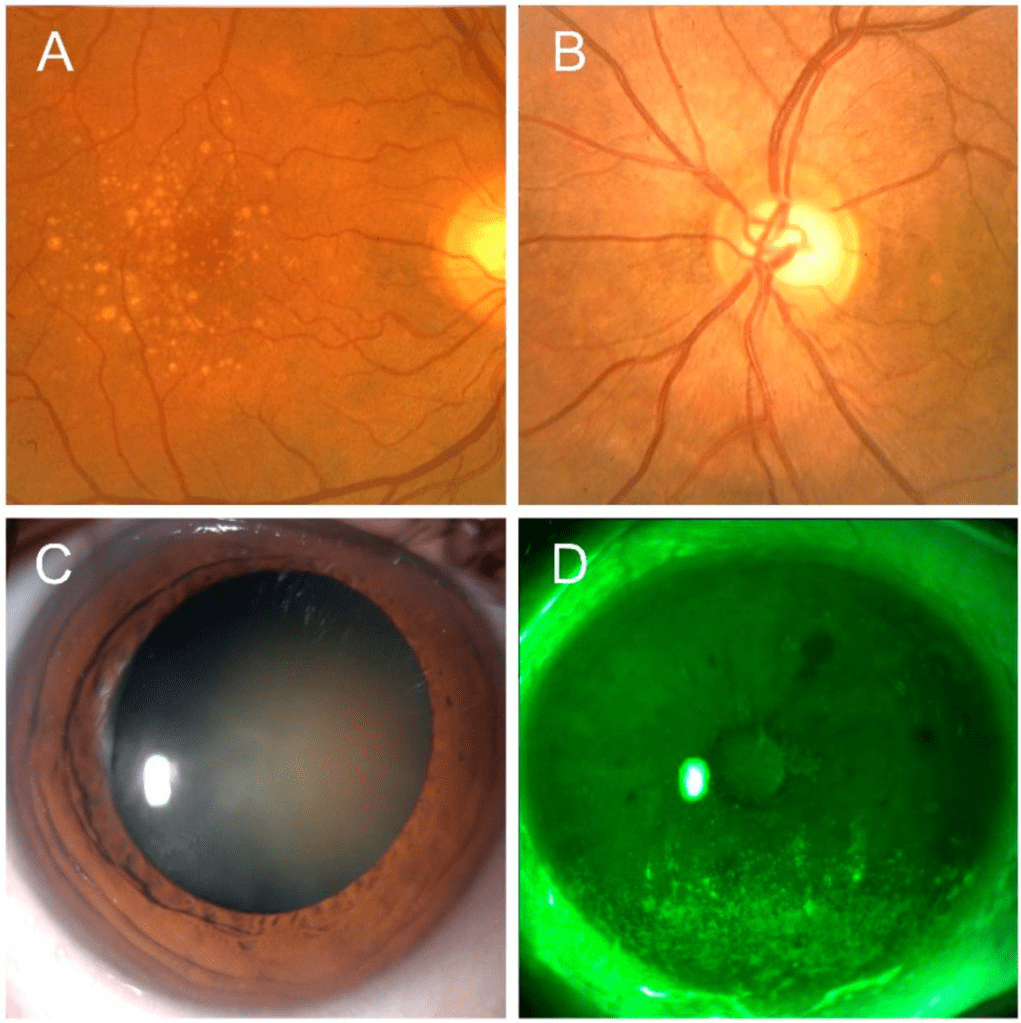
臨床前和臨床證據支持蝦紅素在預防和治療圖2所示的多種眼科疾病中的潛在用途。
視網膜疾病
視網膜是眼睛最內層對光敏感的神經層,是人體代謝最活躍的組織,對氧氣的需求始終很高,且幾乎持續暴露於光線。這兩種條件導致眼睛容易受到輻射引發的氧化損傷和隨後的炎症。視網膜神經節細胞死亡是許多視網膜疾病(如青光眼、視神經病變和糖尿病視網膜病變)的共同特徵,而RPE細胞死亡在AMD發病機制中起關鍵作用。這些病症大多以氧化應激、缺血和凋亡為主要致病因素[16,26,31-34]。
老年性黃斑變性是發達國家成年人視力喪失的主要原因之一,由於負責清晰和高分辨率視力的黃斑區光感受器退化而發生。黃斑變性逐漸導致視力喪失,隨後顯著影響患者的生活質量和日常生產力。光感受器暴露於光和氧的廣泛氧化應激中,因此每天外側10%的光感受器片段會脫落[35]。隨後的碎片被視網膜色素上皮(RPE)吞噬並清除,RPE執行包括光吸收、上皮運輸和分泌以及免疫調節等多種功能[36]。由於RPE功能障礙,局部穩態平衡被打破,玻璃膜-RPE區域可能發現玻璃膜疣,這是早期和/或乾性AMD的已確立臨床指標,如圖2A所示。這些不可消化的物質積累可能導致外段的機械位移並改變光感受器與脈絡膜毛細血管之間的營養交換途徑[37]。先前研究蝦紅素對光誘導視網膜損傷保護作用的作者已證實其有益作用[31,38,39]。在Otzuka的研究中,蝦紅素100毫克/公斤抑制了光誘導視網膜損傷小鼠模型中通過視網膜電圖(ERG)和外核層(ONL)厚度評估的視網膜功能障礙。此外,它同時減少了細胞氧化應激,如8-羥基-脫氧鳥苷(8-OHdG)水平的降低所示[39]。
人類研究也報導了ERG模式的改善,如Parisi及其合作者進行的一項比較研究所示,該研究評估了短期口服類胡蘿蔔素補充劑(包括蝦紅素)對AMD環境中視網膜功能的影響。27名非晚期AMD患者被招募並隨機分為兩組:15名患者每天口服維生素C(180毫克)、維生素E(30毫克)、鋅(22.5毫克)、銅(1毫克)、葉黃素(10毫克)、玉米黃質(1毫克)和蝦紅素(4毫克)持續12個月,而12名患者未接受膳食補充。與安慰劑組相比,治療組患者顯示出中央視網膜功能的選擇性改善,這裡類胡蘿蔔素作為內源性色素自然更為豐富[40]。
在另一項多中心、前瞻性、開放標籤隨機研究中,接受葉黃素/玉米黃質和蝦紅素組合治療兩年的AMD患者更有可能報告視力、對比敏感度和視覺相關功能的顯著改善[41]。此外,蝦紅素由於其更強的抗氧化活性(比玉米黃質和葉黃素高約十倍),解決了AMD的另一個致病因素,即脈絡膜新生血管化(CNV)。事實上,CNV是由於RPE、玻璃膜和脈絡膜毛細血管附近的氧化應激和慢性炎症引起的血管內皮生長因子(VEGF)上調而發展的。隨後,這種新的漏水發芽血管生長到視網膜中,通過出血和漏液導致所謂的濕性AMD的發病,導致黃斑從其正常平坦位置隆起並導致中央視力扭曲[42]。作為其功效的證明,蝦紅素治療在激光光凝用於誘導病理性新生血管生長的小鼠模型中顯著抑制了CNV。蝦紅素介導的CNV抑制的分子機制包括下調多種炎症介質,包括ICAM-1、MCP-1、巨噬細胞來源的VEGF和IL-6,以及內皮來源的VEGFR[43]。
慢性氧化應激和炎症被認為是糖尿病視網膜病變的主要原因,這是糖尿病最嚴重的威脅視力的併發症。視網膜血管對系統狀態的微小變化敏感,高血糖損傷後早期出現血管病變。多羥基途徑的增加、先進糖基化終產物(AGEs)的增強形成、己糖胺途徑的上調和PKC激活導致氧化劑的增加,隨後誘發血管功能障礙,包括膜增厚、周細胞脫落和視網膜毛細血管無灌注,隨後導致視網膜神經節細胞損失[16]。基於這一假設,含有若干雙鍵以清除ROS的蝦紅素生物活性化合物在多個糖尿病視網膜病變實驗模型中顯示出神經保護作用,通過減少氧化應激、抑制NF-κB活性並下調下游炎症介質的表達,這些介質是病理性CNV的主要刺激因素[16,44,45]。在Yeh及其合作者的研究中,50隻雌性Wistar大鼠接受鏈脲佐菌素(STZ)注射以誘發糖尿病,然後隨機分為四組,每天接受八週的治療:生理鹽水;0.6毫克/公斤蝦紅素;3毫克/公斤蝦紅素;0.5毫克/公斤葉黃素。接受蝦紅素治療的組顯示出糖尿病視網膜病變的組織學和功能結果的保存,這與氧化應激和炎症的減少一致,如氧化介質(8-羥基-2′-脫氧鳥苷、硝基酪氨酸和丙烯醛)水平降低、抗氧化酶(血紅素加氧酶-1和過氧化還原酶)水平升高以及轉錄因子核因子-κB(NF-κB)活性降低所示[16]。在Benlarbi-Ben Khedher的另一項研究中,評估了蝦紅素對醛糖還原酶(AR)活性的影響,這是多羥基途徑中負責糖尿病微血管併發症發病機制的關鍵酶,在2型糖尿病啮齒動物模型中進行了體外和體內評估。樣本每天一次接受蝦紅素(4.8毫克/公斤體重)補充一周。結果顯示,蝦紅素補充後AR活性在體內和體外均顯著降低,因此支持其在糖尿病視網膜病變預防和早期治療中的作用[44]。
此外,蝦紅素的神經保護作用可用於青光眼的管理,其中升高的眼壓導致篩板變形和隨後的血流紊亂,從而引起軸突損失和視網膜神經節細胞凋亡,伴隨典型的視神經損傷,如圖2B所示[46]。目前青光眼患者的治療主要基於降低眼壓的藥物;然而,這種治療策略可能不足以阻止疾病進展,因為包括氧化應激在內的多種其他機制可能參與青光眼損傷的發病機制[47]。已提出,氧化應激除了直接損害視網膜神經節細胞層外,還可能損害小梁網功能,這是眼房水從前房流出的主要途徑[48]。總體而言,這些發現支持開發青光眼神經保護療法的需求。在這方面,蝦紅素因其抗氧化、抗炎和抗凋亡特性而作為針對神經退行性疾病(包括帕金森病、阿爾茨海默病、腦和脊髓損傷以及神經病理性疼痛)的多靶點藥理劑引起了越來越多的興趣[2]。事實上,它抑制ILs、TNF-α、細胞間黏附分子(ICAM1)和單核細胞趨化蛋白(MCP-1)的分泌,並通過將自由基添加到其長雙鍵鏈中穩定自由基,而不中斷自由基連鎖反應,從而保護細胞結構。此外,蝦紅素通過阻斷p-ERk/ERK、細胞色素C、胱天蛋白酶3,9和Bax2/Bcl2比率來對抗凋亡[5]。
Cort及其合作者評估了蝦紅素對青光眼視網膜損傷的抑制作用,他們在小鼠模型上進行了一項實驗研究,通過單側燒灼鞏膜外血管誘導升高的眼壓。樣本隨機分為兩組,接受橄欖油或5毫克/公斤/天的蝦紅素治療八週。實驗期結束時,通過視覺誘發電位(VEP)的電生理測量以及視網膜凋亡和氧化標記物表達的評估確定蝦紅素的神經保護作用。與對照組相比,升高眼壓增加了視網膜蛋白氧化,而在接受蝦紅素治療的組中恢復到基線水平。
此外,所有升眼壓組檢測到增強的凋亡,而接受蝦紅素治療的組顯示凋亡細胞百分比顯著減少。此外,蝦紅素治療恢復了改變的VEP參數,這可以被認為是評估眼壓升高情況下視覺系統最早變化的敏感且可靠的方法[32]。
與上述這種葉黃素類胡蘿蔔素的神經保護作用一致,最近提出了蝦紅素在非動脈炎性前部缺血性視神經病變(NAION)中的潛在用途,這是50歲以上人群急性缺血性視力喪失的最常見原因[49]。迄今為止,NAION尚無有效療法,預後較差。最近在NAION患者中發現血漿氧化標記物水平升高,表明氧化過程在後睫狀循環中小血管自調節紊亂的發病機制中起關鍵作用,隨後導致血管不足和視神經頭缺血[50]。在這方面,Lin及其合作者調查了蝦紅素給藥在NAION實驗大鼠模型中的效果,顯示這種類胡蘿蔔素能夠在缺血性損傷後保持視覺功能並減少視網膜神經節細胞凋亡。有趣的是,小鼠每天補充蝦紅素(100毫克/公斤/天),無論是在誘導視網膜氧化應激之前還是之後進行光動力治療。無論蝦紅素給藥時間如何,所有治療組均因蝦紅素有效下調氧化和炎症級聯反應而獲得神經保護效果[33]。
葡萄膜炎
葡萄膜炎是一個涵蓋影響眼睛中層的廣泛炎症狀況的統稱,是視力喪失和眼痛的常見原因。葡萄膜炎中血-房水屏障的破壞涉及細胞浸潤、蛋白滲透性的增加以及房水和葡萄膜區域中細胞因子和趨化因子(如TNF-α、IL-6、MCP-1和MIP-1)的上調[51]。這種炎症級聯反應總是與氧化應激的增加相關。事實上,細胞因子和趨化因子通過線粒體呼吸鏈反應、花生四烯酸代謝反應和膜結合的超氧化物生成酶NADPH氧化酶誘導細胞內ROS生成。這些氧化產物反過來通過NF-κB激活增強炎症級聯反應,並一起改變細胞和分子靶點,破壞正常組織穩態[51,52]。在Ohgami及其合作者的研究中,蝦紅素以劑量依賴性方式抑制了實驗誘導的葡萄膜炎的發展。在通過足墊注射脂多糖(LPS)誘導葡萄膜炎後,在LPS治療前30分鐘、同時或後30分鐘靜脈內給予蝦紅素或潑尼松龍。然後,測定LPS治療24小時後收集的房水中浸潤細胞數量和蛋白濃度。結果,蝦紅素給藥顯著減少了NO、PGE2和TNF-α的產生,通過直接阻斷NOS酶活性實現[44]。有趣的是,100毫克/公斤蝦紅素的眼部抗炎效果與10毫克/公斤潑尼松龍相當[53]。Suzuki及其合作者採用上述研究的相同設計模型,證實了這種微藻來源的類胡蘿蔔素的抗炎有效性,如葡萄膜炎小鼠模型中房水的細胞浸潤、蛋白濃度和細胞因子水平降低所示[54]。
白內障
白內障發展導致眼睛自然晶狀體的混濁,從而降低視力。它仍是全球盲病的主要原因之一,需要手術恢復視力[55]。晶狀體蛋白通常以可溶相存在,這種溶解性負責透明度。在某些情況下,如衰老、糖尿病、類固醇使用和創傷,蛋白質離開可溶相形成高分子量聚集体,這導致光的散射和晶狀體混濁[56]。在這一分子反應級聯中,氧化應激似乎起著關鍵作用,因為它引起蛋白質修飾、脂質過氧化和DNA斷裂,所有這些過程都被認為有助於白內障形成。基於這一假設,蝦紅素的強大抗氧化能力可用於預防白內障發展。迄今為止,關於蝦紅素在與年齡相關的白內障(臨床實踐中最常見的白內障亞型)中的使用的證據仍然缺失。相反,最近在高血糖和長期類固醇使用引起的實驗小鼠模型中研究了蝦紅素的有益活性。事實上,在類固醇誘導的白內障實驗模型中,蝦紅素給藥有效預防了晶狀體混濁並顯著恢復了穀胱甘肽水平,表明抗氧化活性是預防白內障的主要機制[57]。此外,最近的一項研究顯示,蝦紅素補充通過抑制糖尿病小鼠模型中的氧化應激延緩了代謝性白內障的發展和進展,如先進糖基化終產物水平顯著降低所示[58]。
眼表
眼表,特別是角膜和結膜,幾乎持續暴露於陽光,包括紫外線,這是生物系統中氧化應激的已知誘因。如前所述,炎症和氧化應激密切相關,並協同作用成為眼表疾病的主要致病因素[59]。
乾眼症作為眼表系統受損的最佳模型,其特徵是氧化應激標記物和ROS顯著增加,這些因素負責改變上皮增殖和分化穩態,如增殖減少、向上遷移和凋亡細胞增加所示,如圖1D所示[60]。
特別是,淚液量減少、不穩定的淚膜和過度淚液蒸發導致高滲透壓環境的形成,隨後引發炎症和氧化級聯反應[15,61]。基於此,多項臨床試驗已評估多種營養保健品在改善乾眼患者淚膜穩定性和瞼板腺功能障礙方面的療效[62-64]。關於蝦紅素,其治療乾眼症的療效已在包括多種營養保健品的聯合治療中進行了評估。特別是,一項前瞻性隨機雙盲研究比較了含有花青苷、蝦紅素、維生素A、C、E以及若干草藥提取物(包括決明子和麥門冬)的抗氧化補充劑與安慰劑在乾眼症患者中的效果。補充期間持續8週,患者每4週隨訪一次,總共16週。結果顯示,口服微量營養素補充顯著改善了淚液生成和穩定性,同時減少了角膜螢光染色和淚液ROS水平,從而顯著改善了症狀和體徵[65]。使用蝦紅素的理由源於其直接解決疾病惡性循環的能力,特別是潛在的炎症和氧化應激。
眼疲勞
眼疲勞,又稱眼疲勞,是一種常見的日常週期性狀況,表現為非特異性症狀,包括不適、流淚、視力模糊、光敏感,在更嚴重的情況下還有疼痛。蝦紅素可能緩解使用電腦顯示器的眼疲勞,如Nagaki及其合作者進行的一項雙盲隨機臨床試驗所示,他們招募了視覺顯示終端工作者並給予他們蝦紅素或安慰劑。研究結果通過使用適當儀器測量眼肌耐力進行客觀評估。接受蝦紅素的受試者與安慰劑組相比,體驗到顯著的眼疲勞緩解[66]。此外,據報導,40歲以上健康人每天一次接受4或12毫克蝦紅素補充28天後,未矯正遠視力顯著改善,調節時間顯著減少[67]。此外,在單獨使用或包含在多種膳食補充劑中的蝦紅素給藥後,受試者的調節能力和瞳孔收縮能力也顯著改善。Kono及其合作者進行了一項隨機雙盲研究,調查含有葉黃素、蝦紅素、花青素-3-葡萄糖苷和二十二碳六烯酸(DHA)的多種膳食補充劑是否會改善老年和老年受試者的調節能力,他們抱怨眼疲勞。在攝入前後四週評估近點調節(NPA)和主觀症狀。結果,補充組報告NPA和主觀症狀(如“肩膀或頸部僵硬”和視力模糊)均有所改善。這種療效的機制可能與蝦紅素對睫狀肌的放鬆作用、增加視網膜毛細血管血流以及減少睫狀體中NF-κB有關[68,69]。由於智能手機和平板電腦等緊湊型終端的廣泛使用,這些活動對調節系統造成日常過載,從而顯著促成眼疲勞的發展,因此這些作用非常有用[68]。
討論
越來越多的證據表明,蝦紅素在預防和治療從眼前段到後段的多種眼科疾病中具有有益的多效應。作為人體組織的生理成分,來自食物攝入或營養保健品的微量營養素可以作為生物活性化合物,通過參與旨在保持穩態平衡的多種代謝細胞途徑,影響眼部組織的形態和功能。包括抗炎和抗氧化活性以及代謝調節在內的廣泛特性使蝦紅素成為適宜的多靶點藥理劑。此外,這種天然類胡蘿蔔素的優勢在於直接解決眼科疾病的主要致病因素,如累積氧化應激和慢性亞臨床炎症。此外,蝦紅素顯示出良好的安全性,臨床研究中未報告任何不良事件[6,7]。臨床前和臨床研究的數據表明,均衡且完整的營養對支持眼部健康的重要性。基於此,像蝦紅素這樣的營養保健品不僅可用於填補營養差距(補充用途),還可通過與常規療法協同作用治療各種病理狀況(治療用途)。然而,需要從人類干預研究中獲取更多信息來確定蝦紅素應用的持續時間和方式,因為大多數可用證據基於臨床前動物研究。雖然報告了積極結果,但由於從動物模型到人類臨床試驗的轉化複雜,應謹慎解釋結果。綜合考慮,這種類胡蘿蔔素的廣泛安全性[70]及其在多種普遍系統性疾病中的潛在用途[71,72]開闢了支持、保持和改善眼部健康以及對抗眼科疾病自然進程的新治療視角。為了改善其有益效果,需要研究提高其生物利用度[73],同時希望從針對明確定義人群的隨機對照研究中獲得更多數據,以根據不同臨床指征確定適當劑量和確切成分。
參考文獻:
- 1.Ambati R.R., Phang S.M., Ravi S., Aswathanarayana R.G. Astaxanthin: Sources, extraction, stability, biological activities and its commercial applications—A review. Mar. Drugs. 2014;12:128–152. doi: 10.3390/md12010128. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Yuan J.P., Peng J., Yin K., Wang J.H. Potential health-promoting effects of astaxanthin: A high-value carotenoid mostly from microalgae. Mol. Nutr. Food Res. 2011;55:150–165. doi: 10.1002/mnfr.201000414. [DOI] [PubMed] [Google Scholar]
- 3.Boussiba S. Carotenogenesis in the green alga Haematococcus pluvialis: Cellular physiology and stress response. Physiol. Plant. 2000;108:111–117. doi: 10.1034/j.1399-3054.2000.108002111.x. [DOI] [Google Scholar]
- 4.Kidd P. Astaxanthin, cell membrane nutrient with diverse clinical benefits and anti-aging potential. Altern. Med. Rev. 2011;16:355–364. [PubMed] [Google Scholar]
- 5.Fakhri S., Abbaszadeh F., Dargahi L., Jorjani M. Astaxanthin: A mechanistic review on its biological activities and health benefits. Pharmacol. Res. 2018;136:1–20. doi: 10.1016/j.phrs.2018.08.012. [DOI] [PubMed] [Google Scholar]
- 6.Davinelli S., Nielsen M.E., Scapagnini G. Astaxanthin in Skin Health, Repair, and Disease: A Comprehensive Review. Nutrients. 2018;10:522. doi: 10.3390/nu10040522. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Higuera-Ciapara I., Félix-Valenzuela L., Goycoolea F.M. Astaxanthin: A review of its chemistry and applications. Crit. Rev. Food Sci. Nutr. 2006;46:185–196. doi: 10.1080/10408690590957188. [DOI] [PubMed] [Google Scholar]
- 8.Naguib Y.M. Antioxidant activities of astaxanthin and related carotenoids. J. Agric. Food Chem. 2000;48:1150–1154. doi: 10.1021/jf991106k. [DOI] [PubMed] [Google Scholar]
- 9.McNulty H., Jacob R.F., Mason R.P. Biologic activity of carotenoids related to distinct membrane physicochemical interactions. Am. J. Cardiol. 2008;101:20–29. doi: 10.1016/j.amjcard.2008.02.004. [DOI] [PubMed] [Google Scholar]
- 10.McNulty H.P., Byun J., Lockwood S.F., Jacob R.F., Mason R.P. Differential effects of carotenoids on lipid peroxidation due to membrane interactions: X-ray diffraction analysis. Biochim. Biophys. Acta. 2007;1768:167–174. doi: 10.1016/j.bbamem.2006.09.010. [DOI] [PubMed] [Google Scholar]
- 11.Choi H.D., Kim J.H., Chang M.J., Kyu-Youn Y., Shin W.G. Effects of astaxanthin on oxidative stress in overweight and obese adults. Phytother. Res. 2011;25:1813–1818. doi: 10.1002/ptr.3494. [DOI] [PubMed] [Google Scholar]
- 12.Grattagliano I., Palmieri V.O., Portincasa P., Moschetta A., Palasciano G. Oxidative stress-induced risk factors associated with the metabolic syndrome: A unifying hypothesis. J. Nutr. Biochem. 2008;19:491–504. doi: 10.1016/j.jnutbio.2007.06.011. [DOI] [PubMed] [Google Scholar]
- 13.Kim J.H., Chang M.J., Choi H.D. Protective effects of Haematococcus astaxanthin on oxidative stress in healthy smokers. J. Med. Food. 2011;14:1469–1475. doi: 10.1089/jmf.2011.1626. [DOI] [PubMed] [Google Scholar]
- 14.Nakajima Y., Inokuchi Y., Shimazawa M., Otsubo K., Ishibashi T., Hara H. Astaxanthin, a dietary carotenoid, protects retinal cells against oxidative stress in-vitro and in mice in-vivo. J. Pharm. Pharmacol. 2008;60:1365–1374. doi: 10.1211/jpp.60.10.0013. [DOI] [PubMed] [Google Scholar]
- 15.Shimokawa T., Yoshida M., Fukuta T., Tanaka T., Inagi T., Kogure K. Efficacy of high-affinity liposomal astaxanthin on up-regulation of age-related markers induced by oxidative stress in human corneal epithelial cells. J. Clin. Biochem. Nutr. 2019;64:27–35. doi: 10.3164/jcbn.18-27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Yeh P.T., Huang H.W., Yang C.M., Yang W.S., Yang C.H. Astaxanthin Inhibits Expression of Retinal Oxidative Stress and Inflammatory Mediators in Streptozotocin-Induced Diabetic Rats. PLoS ONE. 2016;11:e0146438. doi: 10.1371/journal.pone.0146438. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Hessen M., Akpek E.K. Dry eye: An inflammatory ocular disease. J. Ophthalmic Vis. Res. 2014;9:240–250. [PMC free article] [PubMed] [Google Scholar]
- 18.Kauppinen A., Paterno J.J., Blasiak J., Salminen A., Kaarniranta K. Inflammation and its role in age-related macular degeneration. Cell Mol. Life Sci. 2016;73:1765–1786. doi: 10.1007/s00018-016-2147-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lee S.J., Bai S.K., Lee K.S., Namkoong S., Na H.J., Ha K.S., Han J.A., Yim S.V., Chang K., Kwon Y.G., et al. Astaxanthin inhibits nitric oxide production and inflammatory gene expression by suppressing I(kappa)B kinase-dependent NF-kappaB activation. Mol. Cells. 2003;16:97–105. [PubMed] [Google Scholar]
- 20.Macedo R.C., Bolin A.P., Marin D.P., Otton R. Astaxanthin addition improves human neutrophils function: In vitro study. Eur. J. Nutr. 2010;49:447–457. doi: 10.1007/s00394-010-0103-1. [DOI] [PubMed] [Google Scholar]
- 21.De la Fuente M. Effects of antioxidants on immune system ageing. Eur. J. Clin. Nutr. 2002;56:S5–S8. doi: 10.1038/sj.ejcn.1601476. [DOI] [PubMed] [Google Scholar]
- 22.Park J.S., Chyun J.H., Kim Y.K., Line L.L., Chew B.P. Astaxanthin decreased oxidative stress and inflammation and enhanced immune response in humans. Nutr. Metab. (Lond.) 2010;7:18. doi: 10.1186/1743-7075-7-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Bennedsen M., Wang X., Willén R., Wadström T., Andersen L.P. Treatment of H. pylori infected mice with antioxidant astaxanthin reduces gastric inflammation, bacterial load and modulates cytokine release by splenocytes. Immunol. Lett. 1999;70:185–189. doi: 10.1016/S0165-2478(99)00145-5. [DOI] [PubMed] [Google Scholar]
- 24.Zhang S., Tang M.B., Luo H.Y., Shi C.H., Xu Y.M. Necroptosis in neurodegenerative diseases: A potential therapeutic target. Cell Death Dis. 2017;8:e2905. doi: 10.1038/cddis.2017.286. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Song X.D., Zhang J.J., Wang M.R., Liu W.B., Gu X.B., Lv C.J. Astaxanthin induces mitochondria-mediated apoptosis in rat hepatocellular carcinoma CBRH-7919 cells. Biol. Pharm. Bull. 2011;34:839–844. doi: 10.1248/bpb.34.839. [DOI] [PubMed] [Google Scholar]
- 26.Dong L.Y., Jin J., Lu G., Kang X.L. Astaxanthin attenuates the apoptosis of retinal ganglion cells in db/db mice by inhibition of oxidative stress. Mar. Drugs. 2013;11:960–974. doi: 10.3390/md11030960. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Yamagishi R., Aihara M. Neuroprotective effect of astaxanthin against rat retinal ganglion cell death under various stresses that induce apoptosis and necrosis. Mol. Vis. 2014;20:1796–1805. [PMC free article] [PubMed] [Google Scholar]
- 28.Zhang L., Wang H. Multiple Mechanisms of Anti-Cancer Effects Exerted by Astaxanthin. Mar. Drugs. 2015;13:4310–4330. doi: 10.3390/md13074310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Guo S.X., Zhou H.L., Huang C.L., You C.G., Fang Q., Wu P., Wang X.G., Han C.M. Astaxanthin attenuates early acute kidney injury following severe burns in rats by ameliorating oxidative stress and mitochondrial-related apoptosis. Mar. Drugs. 2015;13:2105–2123. doi: 10.3390/md13042105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Zhang X.S., Zhang X., Wu Q., Li W., Zhang Q.R., Wang C.X., Zhou X.M., Li H., Shi J.X., Zhou M.L. Astaxanthin alleviates early brain injury following subarachnoid hemorrhage in rats: Possible involvement of Akt/bad signaling. Mar. Drugs. 2014;12:4291–4310. doi: 10.3390/md12084291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Otsuka T., Shimazawa M., Inoue Y., Nakano Y., Ojino K., Izawa H., Tsuruma K., Ishibashi T., Hara H. Astaxanthin Protects Against Retinal Damage: Evidence from In Vivo and In Vitro Retinal Ischemia and Reperfusion Models. Curr. Eye Res. 2016;41:1465–1472. doi: 10.3109/02713683.2015.1127392. [DOI] [PubMed] [Google Scholar]
- 32.Cort A., Ozturk N., Akpinar D., Unal M., Yucel G., Ciftcioglu A., Yargicoglu P., Aslan M. Suppressive effect of astaxanthin on retinal injury induced by elevated intraocular pressure. Regul. Toxicol. Pharmacol. 2010;58:121–130. doi: 10.1016/j.yrtph.2010.05.001. [DOI] [PubMed] [Google Scholar]
- 33.Lin W.N., Kapupara K., Wen Y.T., Chen Y.H., Pan I.H., Tsai R.K. Haematococcus pluvialis-Derived Astaxanthin Is a Potential Neuroprotective Agent against Optic Nerve Ischemia. Mar. Drugs. 2020;18:85. doi: 10.3390/md18020085. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Inoue Y., Shimazawa M., Nagano R., Kuse Y., Takahashi K., Tsuruma K., Hayashi M., Ishibashi T., Maoka T., Hara H. Astaxanthin analogs, adonixanthin and lycopene, activate Nrf2 to prevent light-induced photoreceptor degeneration. J. Pharmacol. Sci. 2017;134:147–157. doi: 10.1016/j.jphs.2017.05.011. [DOI] [PubMed] [Google Scholar]
- 35.Schleicher M., Weikel K., Garber C., Taylor A. Diminishing risk for age-related macular degeneration with nutrition: A current view. Nutrients. 2013;5:2405–2456. doi: 10.3390/nu5072405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Boulton M., Dayhaw-Barker P. The role of the retinal pigment epithelium: Topographical variation and ageing changes. Eye (London) 2001;15:384–389. doi: 10.1038/eye.2001.141. [DOI] [PubMed] [Google Scholar]
- 37.Ambati J., Ambati B.K., Yoo S.H., Ianchulev S., Adamis A.P. Age-related macular degeneration: Etiology, pathogenesis, and therapeutic strategies. Surv. Ophthalmol. 2003;48:257–293. doi: 10.1016/S0039-6257(03)00030-4. [DOI] [PubMed] [Google Scholar]
- 38.O’Connor I., O’Brien N. Modulation of UVA light-induced oxidative stress by beta-carotene, lutein and astaxanthin in cultured fibroblasts. J. Dermatol. Sci. 1998;16:226–230. doi: 10.1016/S0923-1811(97)00058-3. [DOI] [PubMed] [Google Scholar]
- 39.Otsuka T., Shimazawa M., Nakanishi T., Ohno Y., Inoue Y., Tsuruma K., Ishibashi T., Hara H. Protective effects of a dietary carotenoid, astaxanthin, against light-induced retinal damage. J. Pharmacol. Sci. 2013;123:209–218. doi: 10.1254/jphs.13066FP. [DOI] [PubMed] [Google Scholar]
- 40.Parisi V., Tedeschi M., Gallinaro G., Varano M., Saviano S., Piermarocchi S., CARMIS Study Group Carotenoids and antioxidants in age-related maculopathy italian study: Multifocal electroretinogram modifications after 1 year. Ophthalmology. 2008;115:324–333. doi: 10.1016/j.ophtha.2007.05.029. [DOI] [PubMed] [Google Scholar]
- 41.Piermarocchi S., Saviano S., Parisi V., Tedeschi M., Panozzo G., Scarpa G., Boschi G., Lo Giudice G., Carmis Study Group Carotenoids in Age-related Maculopathy Italian Study (CARMIS): Two-year results of a randomized study. Eur. J. Ophthalmol. 2012;22:216–225. doi: 10.5301/ejo.5000069. [DOI] [PubMed] [Google Scholar]
- 42.Dryja T.P. Early Insight Into Neovascular Age-Related Macular Degeneration. JAMA Ophthalmol. 2016;134:1281–1282. doi: 10.1001/jamaophthalmol.2016.3031. [DOI] [PubMed] [Google Scholar]
- 43.Izumi-Nagai K., Nagai N., Ohgami K., Satofuka S., Ozawa Y., Tsubota K., Ohno S., Oike Y., Ishida S. Inhibition of choroidal neovascularization with an anti-inflammatory carotenoid astaxanthin. Investig. Ophthalmol. Vis. Sci. 2008;49:1679–1685. doi: 10.1167/iovs.07-1426. [DOI] [PubMed] [Google Scholar]
- 44.Benlarbi-Ben Khedher M., Hajri K., Dellaa A., Baccouche B., Hammoum I., Boudhrioua-Mihoubi N., Dhifi W., Ben Chaouacha-Chekir R. Astaxanthin inhibits aldose reductase activity in Psammomys obesus, a model of type 2 diabetes and diabetic retinopathy. Food Sci. Nutr. 2019;7:3979–3985. doi: 10.1002/fsn3.1259. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Mahajan N., Arora P., Sandhir R. Perturbed Biochemical Pathways and Associated Oxidative Stress Lead to Vascular Dysfunctions in Diabetic Retinopathy. Oxid. Med. Cell Longev. 2019;2019:8458472. doi: 10.1155/2019/8458472. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Floriani I., Quaranta L., Rulli E., Katsanos A., Varano L., Frezzotti P., Rossi G.C., Carmassi L., Rolle T., Ratiglia R., et al. Health-related quality of life in patients with primary open-angle glaucoma. An Italian multicentre observational study. Acta Ophthalmol. 2016;94:278–286. doi: 10.1111/aos.12890. [DOI] [PubMed] [Google Scholar]
- 47.Kimura A., Namekata K., Guo X., Noro T., Harada C., Harada T. Targeting Oxidative Stress for Treatment of Glaucoma and Optic Neuritis. Oxid. Med. Cell Longev. 2017;2017:2817252. doi: 10.1155/2017/2817252. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Saccà S.C., Pascotto A., Camicione P., Capris P., Izzotti A. Oxidative DNA damage in the human trabecular meshwork: Clinical correlation in patients with primary open-angle glaucoma. Arch. Ophthalmol. 2005;123:458–463. doi: 10.1001/archopht.123.4.458. [DOI] [PubMed] [Google Scholar]
- 49.Pellegrini M., Giannaccare G., Bernabei F., Moscardelli F., Schiavi C., Campos E.C. Choroidal Vascular Changes in Arteritic and Nonarteritic Anterior Ischemic Optic Neuropathy. Am. J. Ophthalmol. 2019;205:43–49. doi: 10.1016/j.ajo.2019.03.028. [DOI] [PubMed] [Google Scholar]
- 50.Birer S., Arda H., Kilic D., Baskol G. Systemic oxidative stress in non-arteritic anterior ischemic optic neuropathy. Eye (London) 2019;33:1140–1144. doi: 10.1038/s41433-019-0388-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Yadav U.C., Kalariya N.M., Ramana K.V. Emerging role of antioxidants in the protection of uveitis complications. Curr. Med. Chem. 2011;18:931–942. doi: 10.2174/092986711794927694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Asehnoune K., Strassheim D., Mitra S., Kim J.Y., Abraham E. Involvement of reactive oxygen species in Toll-like receptor 4-dependent activation of NF-kappa B. J. Immunol. 2004;172:2522–2529. doi: 10.4049/jimmunol.172.4.2522. [DOI] [PubMed] [Google Scholar]
- 53.Ohgami K., Shiratori K., Kotake S., Nishida T., Mizuki N., Yazawa K., Ohno S. Effects of astaxanthin on lipopolysaccharide-induced inflammation in vitro and in vivo. Investig. Ophthalmol. Vis. Sci. 2003;44:2694–2701. doi: 10.1167/iovs.02-0822. [DOI] [PubMed] [Google Scholar]
- 54.Suzuki Y., Ohgami K., Shiratori K., Jin X.H., Ilieva I., Koyama Y., Yazawa K., Yoshida K., Kase S., Ohno S. Suppressive effects of astaxanthin against rat endotoxin-induced uveitis by inhibiting the NF-kappaB signaling pathway. Exp. Eye Res. 2006;82:275–281. doi: 10.1016/j.exer.2005.06.023. [DOI] [PubMed] [Google Scholar]
- 55.Scorcia V., Soda M., Lucisano A., Lanza M., Giannaccare G. A Preliminary Comparative Study of Visual Performance Between Two Newly Commercially Available Monofocal Intraocular Lenses Implanted During Cataract Surgery. Clin. Ophthalmol. 2020;14:831–835. doi: 10.2147/OPTH.S246319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Kaur A., Gupta V., Christopher A.F., Malik M.A., Bansal P. Nutraceuticals in prevention of cataract—An evidence based approach. Saudi J. Ophthalmol. 2017;31:30–37. doi: 10.1016/j.sjopt.2016.12.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Ishikawa S., Hashizume K., Nishigori H., Tezuka Y., Sanbe A., Kurosaka D. Effect of astaxanthin on cataract formation induced by glucocorticoids in the chick embryo. Curr. Eye Res. 2015;40:535–540. doi: 10.3109/02713683.2014.935445. [DOI] [PubMed] [Google Scholar]
- 58.Yang M., Chen Y., Zhao T., Wang Z. Effect of astaxanthin on metabolic cataract in rats with type 1 diabetes mellitus. Exp. Mol. Pathol. 2020;113:104372. doi: 10.1016/j.yexmp.2020.104372. [DOI] [PubMed] [Google Scholar]
- 59.Pellegrini M., Senni C., Bernabei F., Cicero A.F.G., Vagge A., Maestri A., Scorcia V., Giannaccare G. The role of nutrition and nutritional supplements in ocular surface diseases. Nutrients. 2020;12:952. doi: 10.3390/nu12040952. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Nakamura S., Shibuya M., Nakashima H., Hisamura R., Masuda N., Imagawa T., Uehara M., Tsubota K. Involvement of oxidative stress on corneal epithelial alterations in a blink-suppressed dry eye. Investig. Ophthalmol. Vis. Sci. 2007;48:1552–1558. doi: 10.1167/iovs.06-1027. [DOI] [PubMed] [Google Scholar]
- 61.Giannaccare G., Pellegrini M., Bernabei F., Scorcia V., Campos E. Ocular surface system alterations in ocular graft-versus-host disease: All the pieces of the complex puzzle. Graefes Arch. Clin. Exp. Ophthalmol. 2019;257:1341–1351. doi: 10.1007/s00417-019-04301-6. [DOI] [PubMed] [Google Scholar]
- 62.Giannaccare G., Pellegrini M., Sebastiani S., Bernabei F., Roda M., Taroni L., Versura P., Campos E.C. Efficacy of Omega-3 Fatty Acid Supplementation for Treatment of Dry Eye Disease: A Meta-Analysis of Randomized Clinical Trials. Cornea. 2019;38:565–573. doi: 10.1097/ICO.0000000000001884. [DOI] [PubMed] [Google Scholar]
- 63.Yang C.H., Albietz J., Harkin D.G., Kimlin M.G., Schmid K.L. Impact of oral vitamin D supplementation on the ocular surface in people with dry eye and/or low serum vitamin D. Cont. Lens Anterior Eye. 2018;41:69–76. doi: 10.1016/j.clae.2017.09.007. [DOI] [PubMed] [Google Scholar]
- 64.Riva A., Togni S., Franceschi F., Kawada S., Inaba Y., Eggenhoffner R., Giacomelli L. The effect of a natural, standardized bilberry extract (Mirtoselect®) in dry eye: A randomized, double blinded, placebo-controlled trial. Eur. Rev. Med. Pharmacol. Sci. 2017;21:2518–2525. [PubMed] [Google Scholar]
- 65.Huang J.Y., Yeh P.T., Hou Y.C. A randomized, double-blind, placebo-controlled study of oral antioxidant supplement therapy in patients with dry eye syndrome. Clin. Ophthalmol. 2016;10:813–820. doi: 10.2147/OPTH.S106455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Nagaki Y., Hayasaka S., Yamada T., Hayasaka Y., Sanada M., Uonomi T. Effects of astaxanthin on accommodation, critical flicker fusion, and pattern visual evoked potential in visual display terminal workers. J. Tradit. Med. 2002;19:170–173. [Google Scholar]
- 67.Nakamura A., Isobe R., Otaka Y., Abematsu Y., Nakata D., Honma C., Sakurai S., Shimada Y., Horiguchi M. Changes in visual function following peroral astaxanthin. J. Clin. Opthamol. 2004;58:1051–1054. [Google Scholar]
- 68.Kajita M., Tsukahara H., Kato M. The effects of a dietary supplement containing astaxanthin on the accommodation function of the eye in middle-aged and older people. Med. Consult. New Remedies. 2009;46:89–93. [Google Scholar]
- 69.Kono K., Shimizu Y., Takahashi S., Matsuoka S., Yui K. Effect of Multiple Dietary Supplement Containing Lutein, Astaxanthin, Cyanidin-3-Glucoside, and DHA on Accommodative Ability. Curr. Med. Chem. 2014;14:114–125. doi: 10.2174/187152221402150408111137. [DOI] [Google Scholar]
- 70.Cicero A.F., Colletti A. Effects of Carotenoids on Health: Are All the Same? Results from Clinical Trials. Curr. Pharm. Des. 2017;23:2422–2427. doi: 10.2174/1381612823666170207095459. [DOI] [PubMed] [Google Scholar]
- 71.Cicero A.F., Allkanjari O., Busetto G.M., Cai T., Larganà G., Magri V., Perletti G., Robustelli Della Cuna F.S., Russo G.I., Stamatiou K., et al. Nutraceutical treatment and prevention of benign prostatic hyperplasia and prostate cancer. Arch. Ital. Urol. Androl. 2019;91 doi: 10.4081/aiua.2019.3.139. [DOI] [PubMed] [Google Scholar]
- 72.Cicero A.F., Colletti A., Bellentani S. Nutraceutical Approach to Non-Alcoholic Fatty Liver Disease (NAFLD): The Available Clinical Evidence. Nutrients. 2018;10:1153. doi: 10.3390/nu10091153. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Fratter A., Biagi D., Cicero A.F. Sublingual Delivery of Astaxanthin through a Novel Ascorbyl Palmitate-Based Nanoemulsion: Preliminary Data. Mar. Drugs. 2019;17:508. doi: 10.3390/md17090508. [DOI] [PMC free article] [PubMed] [Google Scholar]

發表留言