譯者小結:
研究顯示,攝入的葉黃素可在脊椎動物眼中由RPE65酶轉化為內消旋玉米黃素(meso-zeaxanthin),這一過程在雞胚胎和人類細胞中得到驗證。內消旋玉米黃素是黃斑色素的重要成分,在視窩中心豐富,與葉黃素和玉米黃素共同保護視網膜,降低年齡相關性黃斑變性風險。
重要性
類胡蘿蔔素是植物來源的色素分子,高級生物無法從頭合成。這些具有生理意義的化合物作為強效抗氧化劑和光屏蔽化合物,其補充已被證明可改善如年齡相關性黃斑變性等疾病的進展。植物界存在數百種類胡蘿蔔素,但靈長類黃斑僅含有三種:葉黃素、玉米黃素和內消旋玉米黃素。內消旋玉米黃素在靈長類視窩區域的存在是一個未解釋的現象,因為其缺乏飲食來源。我們展示了RPE65負責在脊椎動物中將葉黃素轉化為內消旋玉米黃素,這是RPE65在類胡蘿蔔素代謝中的獨特角色,超越其在脊椎動物視覺循環中已知的視黃醇異構水解酶功能。
摘要
類胡蘿蔔素是植物來源的色素分子,脊椎動物無法從頭合成,保護靈長類視網膜視窩免受氧化應激和光損傷。內消旋玉米黃素是一種眼部特有的類胡蘿蔔素,無常見飲食來源。它是視窩中心三種主要類胡蘿蔔素之一,但其在眼內生成的機制未知。一種異構酶被認為通過雙鍵移動機制負責將葉黃素轉化為內消旋玉米黃素,但其身份尚未明確。我們先前發現,內消旋玉米黃素在雞胚胎視網膜色素上皮(RPE)/脈絡膜中以發育調節的方式生成,且不受光照影響。在本研究中,我們展示了RPE65,脊椎動物視覺循環的異構水解酶,催化全反式視黃酯異構化為11-順式視黃醇,也是負責脊椎動物內消旋玉米黃素生成的異構酶。其RNA在雞眼發育期間內消旋玉米黃素生成時上調23倍,我們提供了證據顯示,過表達雞或人類RPE65在細胞培養中可從葉黃素生成內消旋玉米黃素。藥理抑制RPE65功能導致雞眼發育期間內消旋玉米黃素生物合成顯著受抑。結構對接實驗顯示,葉黃素的ε環適合RPE65活性位點,靠近非血紅素鐵中心。本報告描述了RPE65在眼部類胡蘿蔔素代謝中先前未被認識的額外活性。
正文
罕見的類胡蘿蔔素內消旋玉米黃素僅存在於高級脊椎動物的眼中(1, 2)。這是大自然中的獨特現象,尤其是因為脊椎動物通常通過飲食獲得類胡蘿蔔素,無法從頭生成這些分子(2, 3)。內消旋玉米黃素在飲食來源中不常見;除了脊椎動物的眼睛,這種類胡蘿蔔素存在於蝦殼、烏龜脂肪和魚皮中(2, 4, 5)。自然界存在數百種類胡蘿蔔素,儘管靈長類攝入超過50種,內消旋玉米黃素是視網膜視窩中心僅有的三種類胡蘿蔔素之一,該區域負責清晰的中心視力。視網膜及視窩周圍視網膜色素上皮(RPE)的退化發生在稱為年齡相關性黃斑變性(AMD)的疾病狀態中。類胡蘿蔔素補充已被證明有效減緩此疾病的進展,因為這些分子能夠保護視窩免受藍光損傷和活性氧(ROS)的侵害(2, 6)。儘管內消旋玉米黃素在視窩中心豐富,其相對於飲食葉黃素和玉米黃素的具體功能仍未知。
葉黃素、玉米黃素和內消旋玉米黃素是視窩中心的三種類胡蘿蔔素(2)。這些分子具有相同的分子式C40H56O2(圖1A)。由於葉黃素和玉米黃素在正常飲食中豐富,長期以來假設一種異構酶可能負責將葉黃素或玉米黃素代謝轉化為內消旋玉米黃素(2)。我們實驗室在鵪鶉的體內研究顯示,餵食氘標記葉黃素的鳥類生成標記的內消旋玉米黃素,而餵食標記的玉米黃素則無此效果(7)。靈長類也觀察到類似結果。當缺乏類胡蘿蔔素的猴子餵食葉黃素時,其視網膜中存在內消旋玉米黃素,但當這些動物維持在富含玉米黃素的飼料上時,未檢測到內消旋玉米黃素(8)。這兩項研究均表明,葉黃素在體內經代謝轉化形成內消旋玉米黃素,但此反應的生化機制未知,儘管在苛刻的工業條件下(如高溫和強鹼)可高效生成(9)。將飲食玉米黃素轉化為內消旋玉米黃素需要3′位手性中心的反轉,這種反應在生物系統中極為罕見。相反,葉黃素轉化為內消旋玉米黃素僅需從4′-5′位置到5′-6′位置的單一雙鍵遷移,這種反應應可通過協同的酸鹼催化輕易實現,如圖1B所示。其他涉及自由基化學的機制也可能成立。
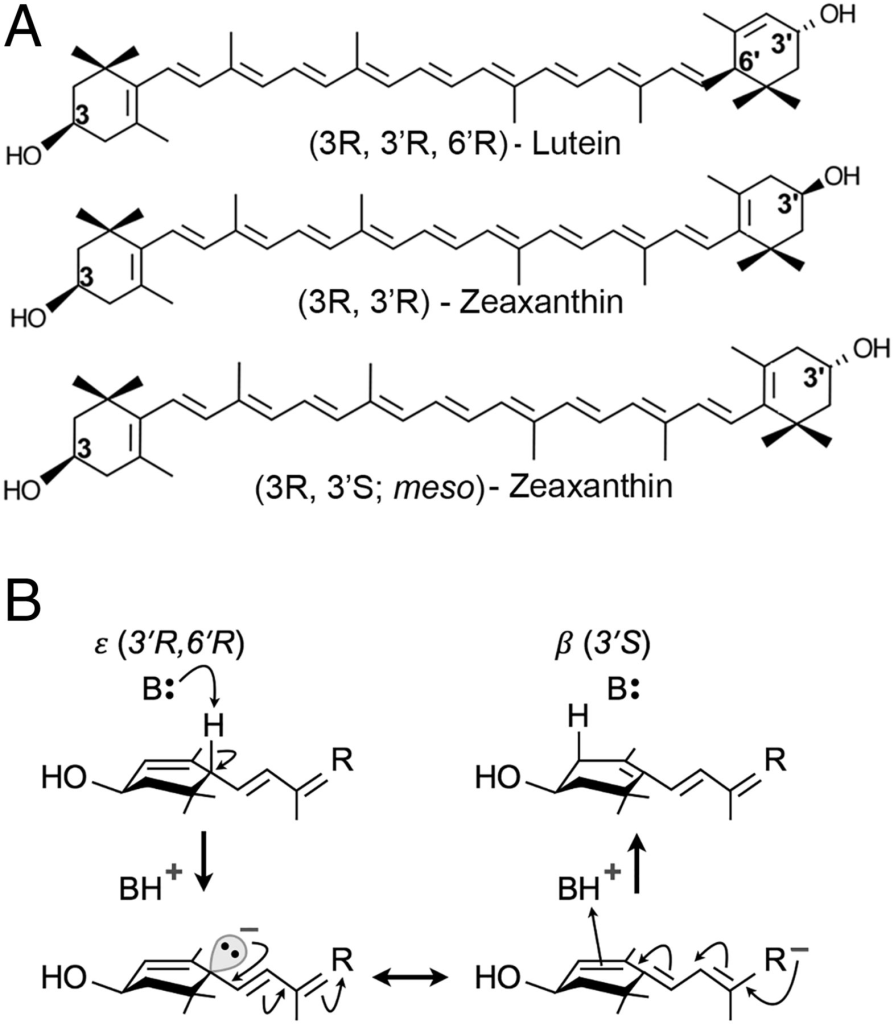
(A)展示了黃斑葉黃素(類胡蘿蔔素)的化學結構。(B)描述了葉黃素轉化為內消旋玉米黃素的簡單協同酸鹼催化機制。第一步涉及鹼催化的質子從ε-紫羅酮環的C6′位置被抽象。預期中間體上的負電荷通過共振穩定(雙頭箭頭表示)。在最後一步,BH+作為質子來源,附著於紫羅酮環的新位置C4′。此處所示的機制闡述了體內轉化可能發生的方式;其他涉及自由基化學的替代機制(如氫原子轉移)也可能存在。
為了探究內消旋玉米黃素形成的生化機制,我們實驗室在發育中的雞胚胎中進行了研究。在這個獨立的系統中,我們確定內消旋玉米黃素在雞胚胎的視網膜色素上皮(RPE)/脈絡膜中以發育調節的方式生成,來源於蛋黃中天然存在的葉黃素和玉米黃素(10)。在先前研究中,我們檢測到E17胚胎的RPE/脈絡膜中存在內消旋玉米黃素,且隨著胚胎接近孵化(E21),其含量逐漸增加(10)。內消旋玉米黃素在視網膜中的檢測僅在E19時出現,而其他檢查的組織(腦、肝、血清和蛋黃)均無此類胡蘿蔔素。由於蛋在黑暗中孵化,我們排除了光在內消旋玉米黃素生成中的作用。在本研究中,我們提供了證據,表明RPE65,脊椎動物視覺循環中負責將全反式視黃基棕櫚酸酯異構化為11-順式視黃醇的異構水解酶(11–14),同時也是葉黃素轉化為內消旋玉米黃素的異構酶。
結果
RPE65在E21雞RPE/脈絡膜中的轉錄本和蛋白質水平顯著上調
為了識別負責在雞RPE/脈絡膜中生成內消旋玉米黃素的酶,我們進行了RNA測序,以確定可能候選基因的轉錄本是否上調。我們使用了從E16 RPE/脈絡膜(此階段RPE/脈絡膜中未檢測到內消旋玉米黃素)分離的總RNA,並比較其mRNA轉錄本表達譜與E21 RPE/脈絡膜(此階段存在大量內消旋玉米黃素)的表達譜。比較了每個階段至少三個胚胎的Log2 FPKM值,並繪製了通常涉及類胡蘿蔔素代謝和運輸(GSTP1、STARD3、STARD1、BCO1、BCO2、SCARB1、SCARB2和CD36)或視黃醇代謝和運輸(RBP1、IRBP、CRALBP、RPE65、LRAT、CYP27C1、STRA6和DES1)的基因轉錄本相對豐度(圖2)。在我們考慮的基因中,RPE65在E16和E21之間上調最為顯著,其轉錄本水平在E21比E16高23倍。GSTP1和STARD3分別為玉米黃素和葉黃素結合蛋白(15, 16),其轉錄本水平在E16和E21之間無顯著增加。BCO1和BCO2是類胡蘿蔔素氧化酶(17–20),其基因在E21略有上調。STRA6是一種視黃醇運輸蛋白(21),DES1是視網膜穆勒細胞中表達的維生素A異構酶(22)。雖然STRA6 mRNA在E21上調,但其增幅低於RPE65。DES1 mRNA水平在發育期間無變化。SCARB1、SCARB2和CD36是眼中類胡蘿蔔素運輸蛋白(23)。雖然SCARB1在E16和E21之間水平增加,但其催化內消旋玉米黃素生成的可能不大。LRAT,視覺色素再生所需的酰基轉移酶,在E21適度上調(12–14)。CYP27C1,一種已知將維生素A1轉化為維生素A2的蛋白(24),在E16和E21之間轉錄本豐度下降。視黃醇運輸蛋白如IRBP、CRALBP和RBP1的表達無顯著差異。根據RNA測序數據,我們得出結論,在涉及視覺循環和類胡蘿蔔素代謝的相關基因中,RPE65最有可能負責內消旋玉米黃素的生成,特別是因為它是兩種類胡蘿蔔素代謝酶BCO1和BCO2的親屬。
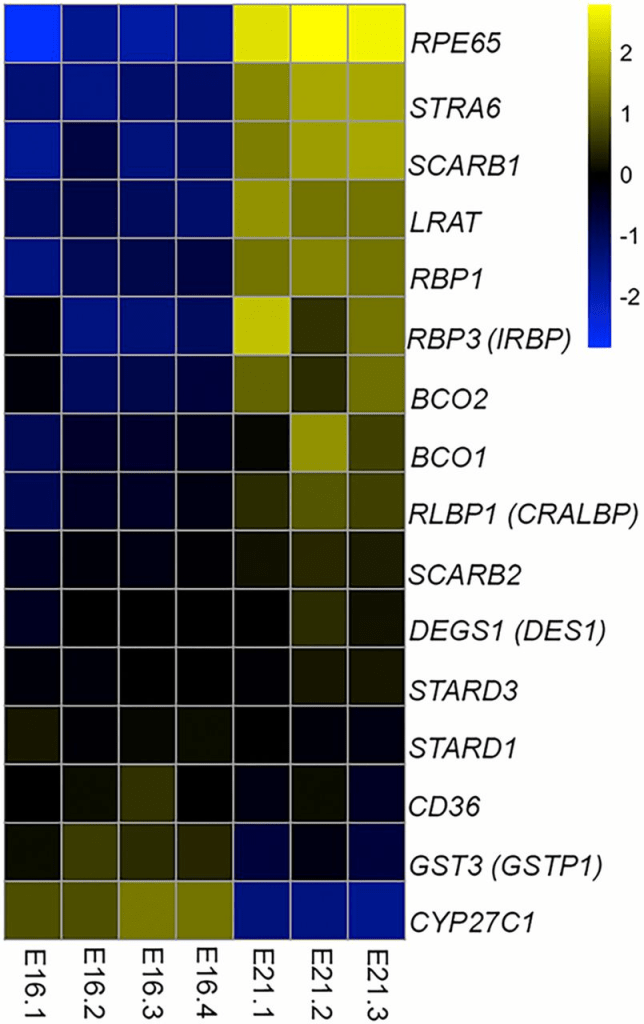
各基因的FPKM值與所有樣本的表達量進行比較,以獲得平均表達量。每個樣本的基因表達比率與平均值相比較,並以對數底2(log2)尺度繪製。數值為正表示高於平均表達量;數值為負表示低於平均表達量。
接下來,我們確定了RPE65的蛋白質表達譜是否顯示出與mRNA水平相似的趨勢。在E16雞RPE/脈絡膜中未檢測到RPE65蛋白質,而在E21組織中觀察到強烈表達(圖S1)。

RPE65過表達導致HEK293T細胞中內消旋玉米黃素的生成
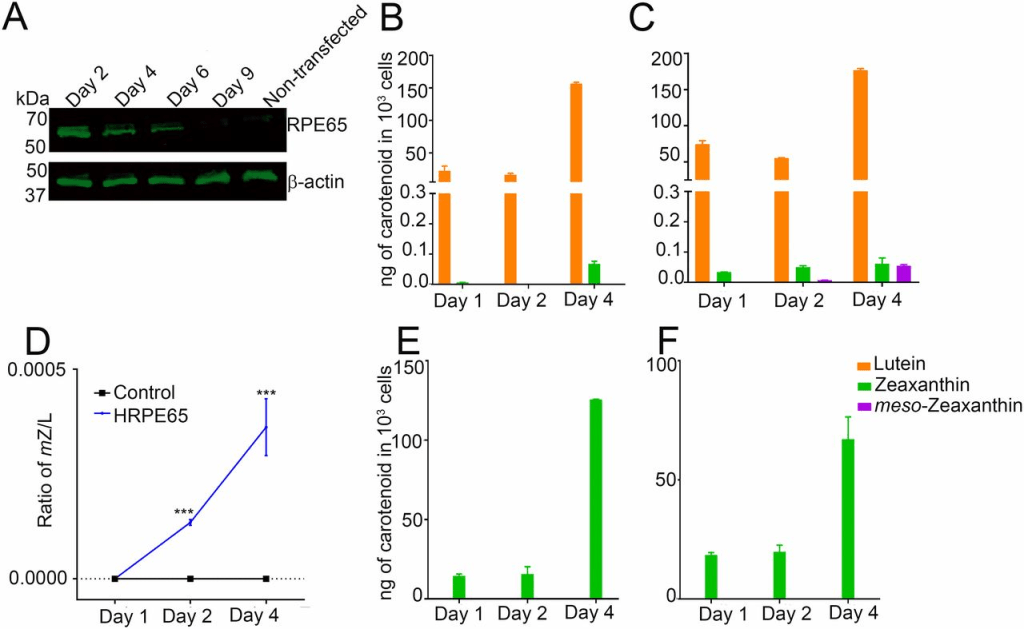
為了確定RPE65是否能催化葉黃素轉化為內消旋玉米黃素,我們使用了非眼部細胞系HEK293T,該細胞系來源於人類胚胎腎臟,且不表達RPE65或LRAT(12, 13)。過表達pCDNA3.1-CRPE65(雞RPE65)在轉染後48小時導致RPE65的強烈表達,並持續4天,而未轉染的細胞未檢測到RPE65(圖3A)。我們向HEK293T細胞提供了經HPLC純化的葉黃素,該葉黃素不含可檢測的內消旋玉米黃素且玉米黃素含量低於0.5%(圖4B),這些細胞本身不含內源性類胡蘿蔔素(圖4C)。以4 μM葉黃素處理長達4天,在RPE65過表達的細胞中內消旋玉米黃素的生成水平逐漸增加,而對照組轉染pCDNA3.1-GFP的細胞未顯示內消旋玉米黃素的存在(圖3B、C和圖4D、E)。生物合成的內消旋玉米黃素的身份通過比較其保留時間與真實類胡蘿蔔素標準品(圖4A)以及使用在線光電二極管陣列檢測觀察其特徵性三峰光譜(最高峰在450納米,圖4F和圖S2)得到確認。我們在實驗組和對照組細胞中觀察到少量玉米黃素,且其含量隨時間增加(圖3B、C)。這可能是因為我們的葉黃素儲備雖不含內消旋玉米黃素,但含有約0.5%的玉米黃素。為排除玉米黃素作為CRPE65過表達細胞中內消旋玉米黃素前體的可能性,我們以4 μM異構純玉米黃素(不含可檢測的葉黃素)處理這些細胞。對照組和實驗組細胞均未顯示可檢測的內消旋玉米黃素或葉黃素水平(圖3E、F)。
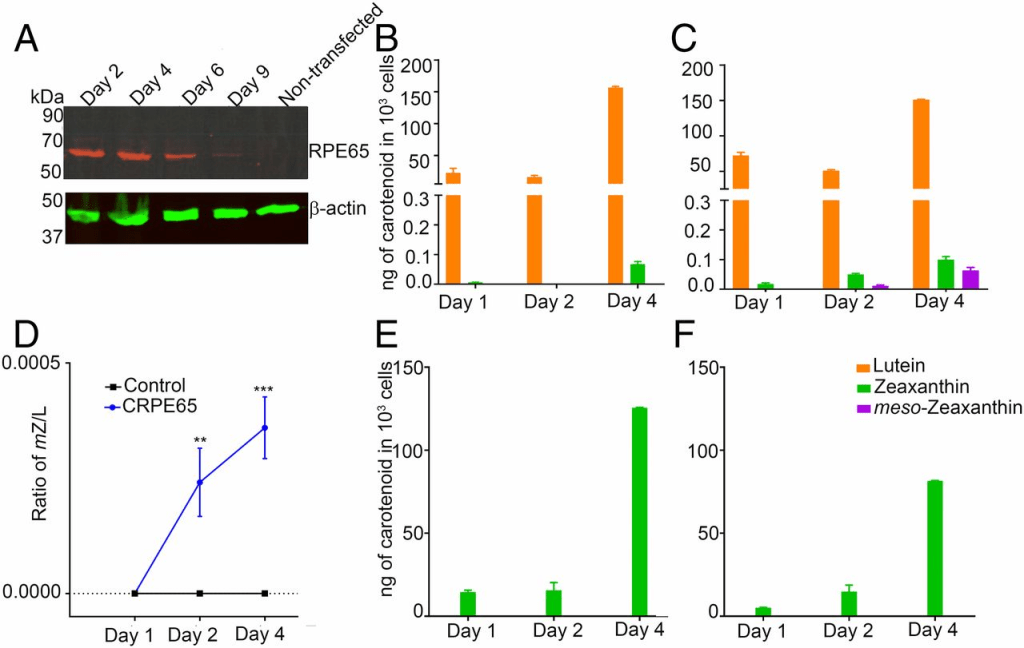
未轉染的HEK293T細胞不表達RPE65,但通過暫態轉染可使該基因表達數天(圖A)。以4 μM葉黃素處理轉染CRPE65的細胞導致內消旋玉米黃素的生成(圖C),而過表達對照質粒的細胞則未含內消旋玉米黃素(圖B)。內消旋玉米黃素與葉黃素的比率顯示後者隨時間增加(圖D)。在過表達對照質粒的細胞(圖E)或CRPE65過表達的細胞中以4 μM玉米黃素處理未產生內消旋玉米黃素(圖F)。n = 3。誤差條表示標準誤差(SEM)。**P < 0.005;***P < 0.0005。
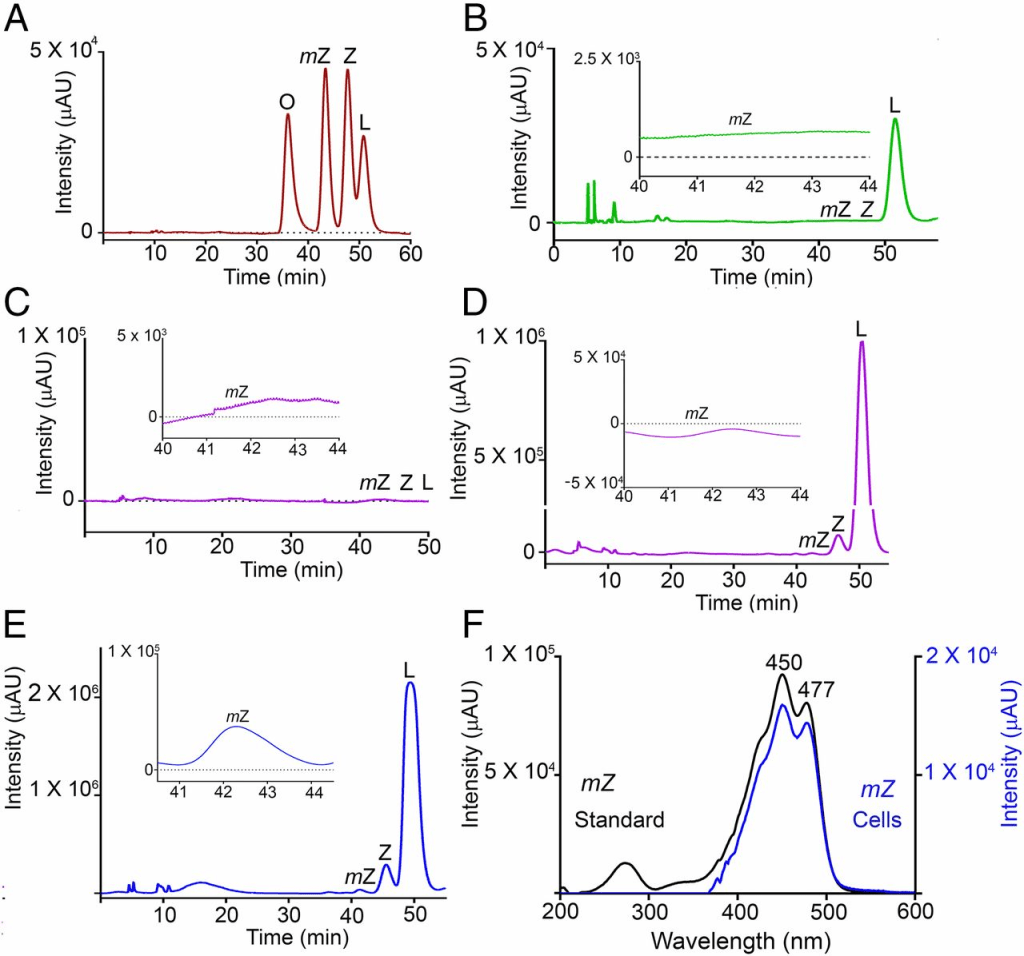
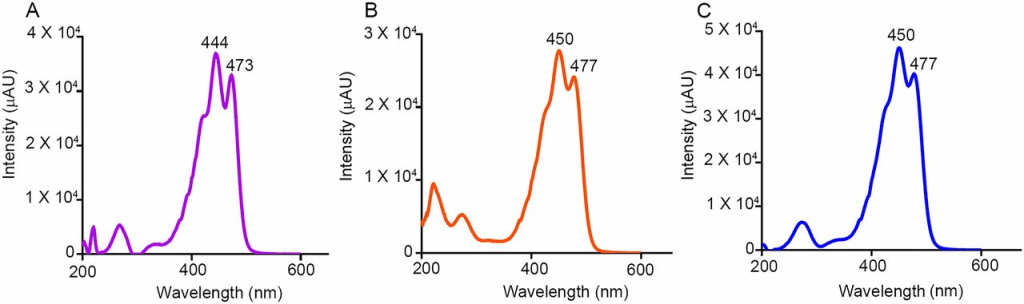
使用在線光電二極管陣列檢測器測量類胡蘿蔔素標準品的光譜。葉黃素的特徵峰在444納米和473納米處檢測到(圖A),而玉米黃素(圖B)和內消旋玉米黃素(圖C)的峰值在450納米和477納米處檢測到。
先前研究顯示,雞RPE65(CRPE65)相較於其人類對應物(HRPE65)具有更佳的異構水解酶活性(25)。我們進行了下一組實驗,以確定人類RPE65(HRPE65)與雞RPE65(CRPE65)在內消旋玉米黃素異構化方面是否存在差異(圖S3)。我們觀察到,HRPE65轉染在第2天產生的內消旋玉米黃素略低於CRPE65;然而,到第4天,過表達CRPE65和HRPE65的細胞內消旋玉米黃素水平相似(圖3C和圖S3C)。與CRPE65相同,以4 μM玉米黃素處理過表達HRPE65的細胞未檢測到內消旋玉米黃素,對照組細胞中也無內消旋玉米黃素存在(圖S3E和F)。比較過表達CRPE65和HRPE65細胞中葉黃素與內消旋玉米黃素的比率顯示,4天內的轉化率低於0.05%(圖3D和圖S3D)。
(A)HEK293T細胞中未檢測到內源性RPE65表達,而過表達pCDNA3.1-人類RPE65導致基因表達在轉染後6天內均可檢測。(B和C)轉染對照質粒的細胞經葉黃素處理未產生內消旋玉米黃素(圖B),而HRPE65細胞則生成此類胡蘿蔔素(圖C)。(D)在過表達HRPE65的細胞中,內消旋玉米黃素與葉黃素的比率隨時間增加。(E和F)以玉米黃素處理過表達對照質粒的細胞(圖E)或過表達HRPE65的細胞(圖F)未產生內消旋玉米黃素。n = 3。誤差條表示標準誤差(SEM)。***P < 0.0005。
E21雞RPE原代細胞保留RPE65表達並能產生內消旋玉米黃素
在這些實驗中,我們探討了來自E21雞胚胎的RPE原代培養細胞在葉黃素處理後是否能產生內消旋玉米黃素。與人類原代RPE細胞不同,這些細胞即使在五次傳代後仍保留RPE65的表達(26)(圖5A)。以2 μM葉黃素處理107個細胞2天後,檢測到內消旋玉米黃素的存在(圖5B)。在第2天至第4天之間,我們觀察到內消旋玉米黃素水平逐漸增加。為了確定更高的前體濃度是否會導致內消旋玉米黃素生成增加,我們以4 μM葉黃素處理這些細胞。相較於以2 μM葉黃素處理的細胞,這些細胞在第2、3和4天產生顯著更高量的內消旋玉米黃素(圖5B)。
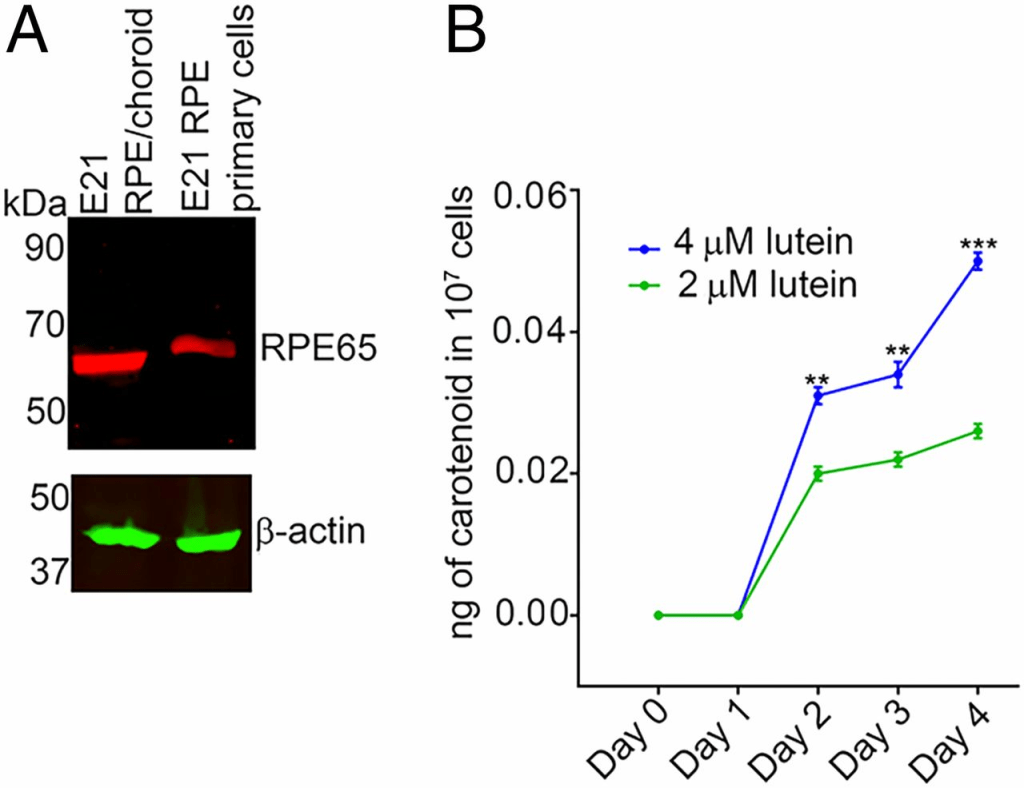
(A)來自E21雞胚胎的RPE原代細胞保留RPE65的表達。(B)當以2 μM葉黃素處理2天後,這些細胞產生內消旋玉米黃素,而以4 μM葉黃素處理時,觀察到更高水平的內消旋玉米黃素生成。n = 3。誤差條表示標準誤差(SEM)。**P < 0.005;***P < 0.0005。
在發育中雞胚胎中藥理抑制RPE65降低內消旋玉米黃素水平
接下來,我們檢驗了藥理抑制RPE65活性是否能特異性地抑制內消旋玉米黃素的生成。我們先前的研究顯示,內消旋玉米黃素在雞RPE/脈絡膜中於E17時首次出現可檢測的水平。因此,我們決定在E17時將RPE65活性的競爭性抑制劑引入雞胚胎的卵黃囊中。
我們使用了藥理抑制劑ACU-5200-HCl(ACU-5200)來敲低RPE65功能。ACU-5200是emixustat的類似物,emixustat是一種高度特異性的RPE65抑制劑,目前正處於用於治療Stargardt病的臨床試驗階段(27–29)(圖6A)。ACU-5200已顯示在動物中以極低口服劑量(小鼠ED50 = 0.27 mg/kg;Acucela Inc.提供的專有數據)抑制11-順式視黃素的生成。我們在E17和E19時分別向發育中胚胎的卵黃囊注射不同劑量的ACU-5200。經ACU-5200注射的胚胎發育正常,無明顯表型異常(圖6B)。注射兩次2毫克劑量(2 × 2毫克)的ACU-5200導致RPE/脈絡膜內消旋玉米黃素水平顯著下調(圖6C)。將劑量加倍後,注射胚胎的RPE/脈絡膜中完全未檢測到內消旋玉米黃素(圖6D)。經ACU-5200注射的胚胎RPE/脈絡膜中的葉黃素和玉米黃素含量與對照胚胎相當(圖6C和D)。這些結果表明,在體內系統中,RPE65的功能對內消旋玉米黃素的生成是必需的。
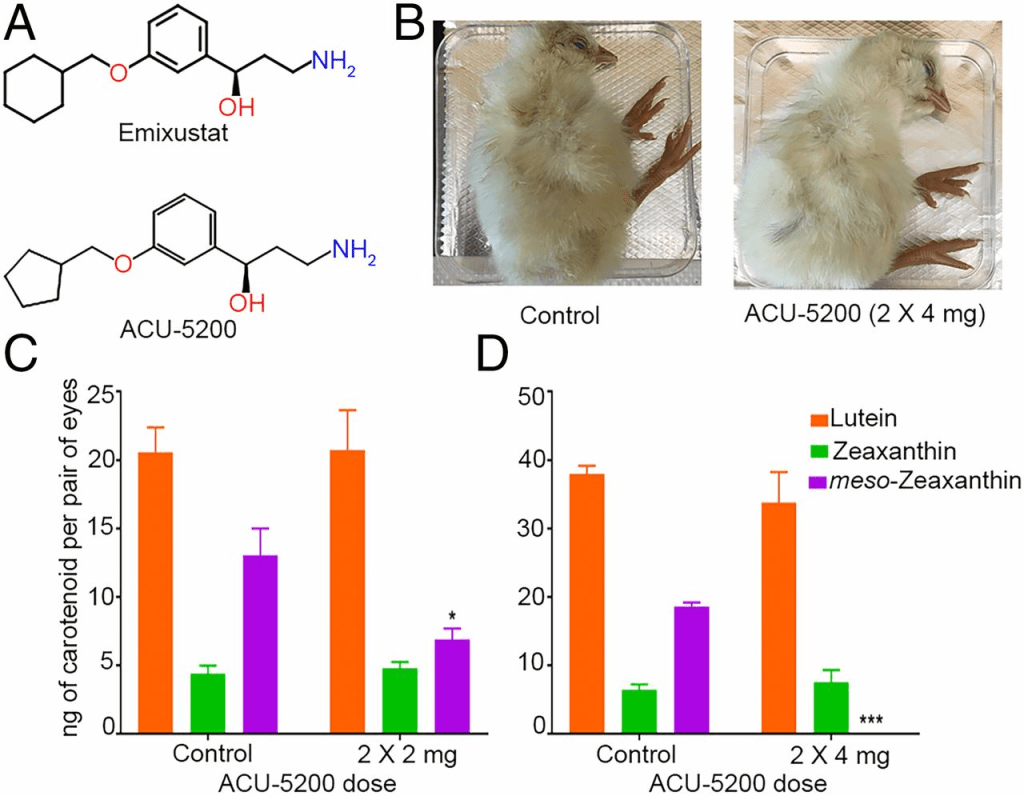
(A)ACU-5200是emixustat的類似物。(B)經ACU-5200注射的胚胎發育與對照胚胎相當。(C和D)與對應的對照胚胎相比,經ACU-5200注射的胚胎在葉黃素或玉米黃素水平上無顯著差異。內消旋玉米黃素水平在ACU-5200注射後顯著下調或完全缺失。n ≥ 5。誤差條表示標準誤差(SEM)。*P < 0.05;***P < 0.0005。
結構對接實驗顯示葉黃素的ε環可適配於RPE65的活性位點
為了確定葉黃素是否適配於RPE65的底物通道,我們將葉黃素分子對接至雞RPE65的同源模型。圖7展示了一個代表性結果,該結果最小化了立體衝突並最大化了氫鍵。葉黃素的ε-紫羅酮環位於由鐵配位組氨酸殘基構成的平台上,而β-紫羅酮環從酶表面的開口處突出。埋藏的羥基與兩個氫鍵結合基團(Trp-331的吲哚胺和Glu-417的羧酸根;圖S4)靠近定位。立體互補性顯而易見,苯丙氨酸殘基在ε-紫羅酮環的兩側靠近,並與聚烯鏈堆疊。包含參與異構化的C4′、C5′和C6′原子的紫羅酮環邊緣始終被發現更靠近鐵中心和組氨酸殘基。在適配良好的對接結果中,未觀察到這些原子指向遠離鐵中心的對接結果,這可能是因為在此取向下,葉黃素分子的曲率與RPE65底物通道的曲率不匹配。
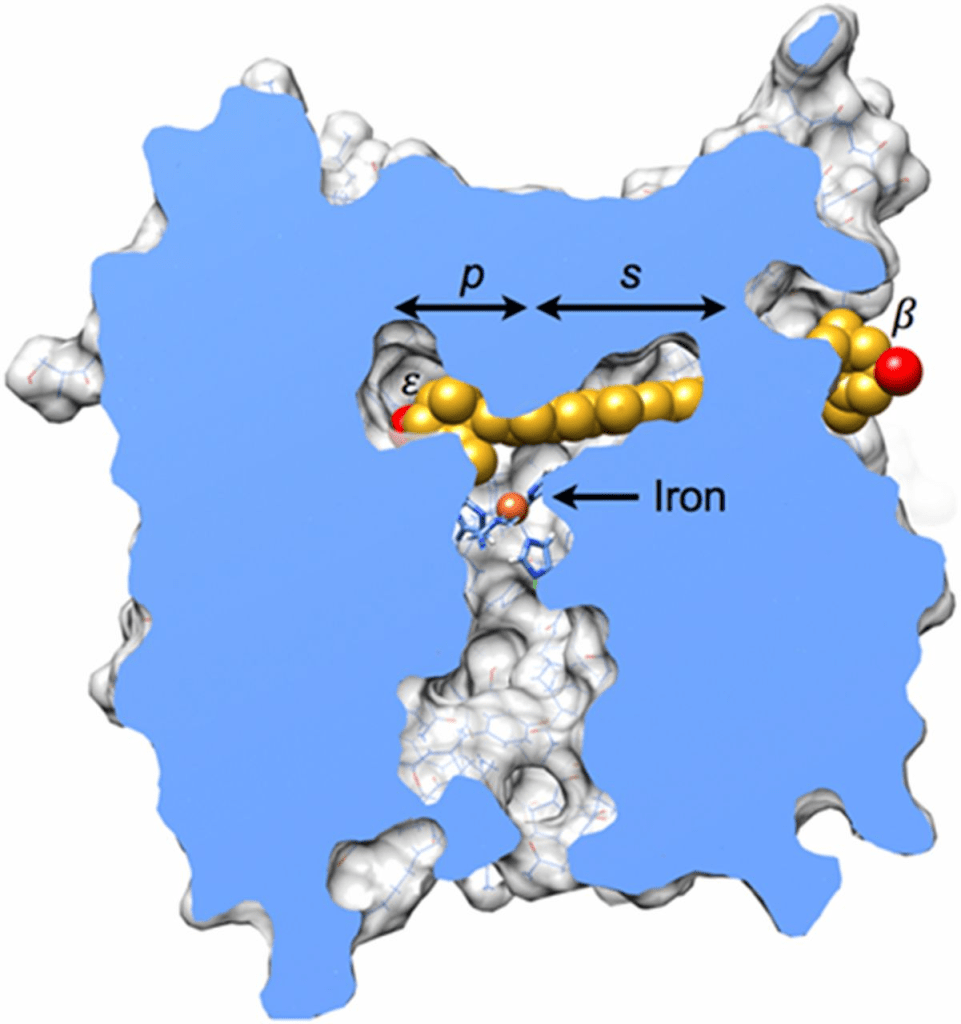
圖中展示了一個葉黃素分子(碳原子為金色,氧原子為紅色)對接到雞RPE65的同源模型中。在此視圖中,大部分蛋白質結構已被移除,以顯示位於內部的底物通道。棕櫚酸結合口袋(p)位於鐵中心上方和左側,與葉黃素的ε-紫羅酮環重疊。聚烯鏈延伸穿過假定的底物結合口袋(s),該口袋由酶與其競爭性抑制劑emixustat複合物的結構定義(29)。β-紫羅酮環從酶表面的一個開口處露出。分子相互作用的更詳細視圖見圖S4。這些粗略網格剛體對接實驗未使用能量最小化。此處展示的代表性結果從超過33,000次試驗中選出,因其立體衝突較少(n = 9;衝突定義為原子間距離小於3Å)並形成兩個氫鍵。通過對葉黃素分子扭轉角度的微調和側鏈的重新定位,立體衝突可能會得到解決。作為比較,使用相同剛體對接協議將葉黃素對接到StARD3的隧道狀腔體中會產生14個衝突(42),棕櫚酸和emixustat與RPE65結合時有兩個衝突,而葉綠素結合蛋白結構中的葉黃素分子通常無衝突(42)。此圖使用UCSF Chimera繪製(43, 44)。
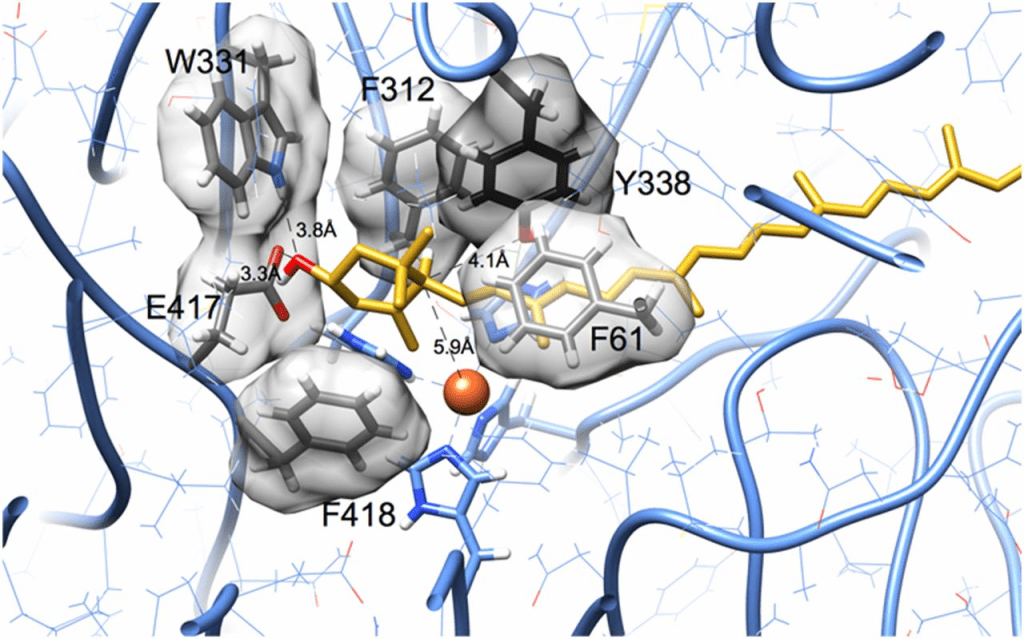
葉黃素的ε-紫羅酮環適配於一個由芳香族側鏈襯裡的口袋中。羥基靠近Trp-331和Glu-417殘基中的潛在氫鍵供體和受體。這些殘基參與一個氫鍵網絡,通過側鏈旋轉異構體的適度調整,可重新排列以包括葉黃素的羥基。在異構化過程中,附著於C6′的氫原子移動到C4′。鐵中心(橙色球體)與環碳C5′最接近,且與C6′和C4′的距離大致相等。C6′原子距離Tyr-338的羥基4.1Å,距離鐵中心(橙色球體)5.9Å。此圖使用UCSF Chimera繪製(43, 44)。
討論
RPE65是視覺循環中的重要酶,負責視覺循環中全反式視黃醇異構化為11-順式視黃醇的關鍵步驟(11–13)。如Leber先天性黑矇和視網膜色素變性等疾病由該基因功能喪失引起(12, 13)。在這裡,我們展示了RPE65具有額外的功能,能將葉黃素轉化為內消旋玉米黃素,一種無常見飲食來源的眼部特有類胡蘿蔔素。由於內消旋玉米黃素在視網膜視窩高濃度積累,這一區域對視銳度至關重要,其假設功能是保護該區域免受藍光損傷和氧化應激,並可能增強視覺功能。支持這一假設的證據包括,先前研究顯示內消旋玉米黃素的抗氧化性能強於葉黃素和玉米黃素(30),另一項研究表明,口服補充所有三種黃斑類胡蘿蔔素可改善正常個體的對比敏感度(31, 32)。內消旋玉米黃素在眼內生成的過程一直是一個謎。在本研究中,我們在體外和體內系統中展示了RPE65是催化葉黃素轉化為內消旋玉米黃素的酶。
通過RNA測序研究確定了RPE65為雞RPE中內消旋玉米黃素異構酶的主要候選後,我們使用雞和人類RPE65質粒在非眼部細胞培養系統中進行了過表達實驗。我們在HEK293T細胞中的研究顯示,兩種物種的RPE65均能從葉黃素生成內消旋玉米黃素,但無法從玉米黃素生成。HEK293T細胞不內源性表達LRAT,LRAT是提供全反式脂肪酸酯視黃醇底物的必需酰基轉移酶,供RPE65催化轉化為11-順式視黃醇(12, 13, 25)。通過在無LRAT的系統中過表達RPE65並以HPLC純化的葉黃素處理這些細胞,我們能夠獨立於LRAT催化活性生成內消旋玉米黃素。該反應在細胞培養中較慢,添加葉黃素後數天內未觀察到可檢測的產物。這與雞眼發育期間內消旋玉米黃素的緩慢形成一致,也需數天時間(10)。
我們的結構建模研究顯示,葉黃素的ε環可與RPE65的活性位點組氨酸和鐵配位,以促進將葉黃素轉化為內消旋玉米黃素所需的雙鍵移動反應,該反應涉及酸鹼催化機制(圖1B)或其他機制。我們還發現,RPE65抑制劑ACU-5200能夠在雞眼發育期間特異性抑制內消旋玉米黃素的形成,而不影響RPE/脈絡膜中葉黃素或玉米黃素的攝取。其近似物emixustat目前正作為視覺循環抑制劑用於多種眼疾的臨床試驗(27–29)。我們發現RPE65在黃斑類胡蘿蔔素代謝中的額外角色表明,應關注這些臨床試驗參與者的黃斑色素水平或分佈是否受到該化合物的顯著影響。
人類RPE65突變極為罕見,通常導致嚴重的視覺功能缺陷,我們推測RPE65有害突變的個體可能也存在黃斑色素水平和分佈的異常。有趣的是,在CAREDS研究中參與的女性中,人類RPE65的單核苷酸多態性(SNP)以及其他類胡蘿蔔素相關基因(如GSTP1、BCO1和SCARB1)被確定為黃斑光學密度的決定因素(33)。
RPE65作為內消旋玉米黃素異構酶的觀念具有吸引力,因為其類胡蘿蔔素氧化酶家族成員BCO1和BCO2是已知的類胡蘿蔔素裂解酶。事實上,RPE65的另一名稱為BCO3。這三種蛋白質共享顯著的序列同源性,每種都在脊椎動物視黃醇和類胡蘿蔔素生理學中扮演關鍵角色。BCO1在中央15,15′位點裂解β-胡蘿蔔素,生成兩分子視黃醛(18)。新形成的全反式視黃醛經還原和轉化為視黃酯,作為RPE65介導生成11-順式視黃醇的底物;或者,視黃醛可被氧化為視黃酸,用於細胞信號傳導和基因調控。BCO2在9′,10′雙鍵處裂解多種葉黃素類胡蘿蔔素底物,參與非前維生素A類胡蘿蔔素的穩態(17)。
在其他物種中,單一酶可執行BCO1、BCO2和RPE65的功能。節肢動物編碼的單一類胡蘿蔔素裂解酶NinaB執行所有三個BCO家族成員的功能(34)。低等生物中的類胡蘿蔔素裂解酶具有多種底物特異性。來自藍細菌的ACO能夠裂解長度從C20到C27的類胡蘿蔔素。該酶與帶有醛或醇基團的底物結合,這些基團位於遠離紫羅酮環的末端,且能接受帶或不帶3-羥基的紫羅酮環的類胡蘿蔔素(35–37)。因此,RPE65此前僅與視黃醇相互作用,但與結構相似的分子如類胡蘿蔔素相互作用並非前所未有。
我們的發現表明,內消旋玉米黃素由葉黃素在RPE中生成,並由RPE65催化。此類胡蘿蔔素在視窩的特定積累可能由特定運輸蛋白和結合蛋白介導。IRBP和B類清道夫受體蛋白能夠通過感光細胞間隙將類胡蘿蔔素從RPE運輸到視網膜層(38, 39)。GSTP1是靈長類RPE和視窩區域已知的玉米黃素結合蛋白,對內消旋玉米黃素具有同樣高的親和力(15)。可以合理假設,從RPE新形成的內消旋玉米黃素被運輸到視網膜下空間,然後通過運輸蛋白進入視網膜層,並在視網膜中由特定結合蛋白固定在視窩區域。
在本研究中,我們描述了RPE65作為葉黃素轉化為內消旋玉米黃素異構酶的新功能。我們展示了雞和人類RPE65均能將葉黃素轉化為內消旋玉米黃素。該反應速率較慢,內消旋玉米黃素異構化可能是RPE65的次要功能。內消旋玉米黃素在視窩的存在,特別是考慮其缺乏常見飲食來源,一直是類胡蘿蔔素生物學領域的難題。隨著RPE65被確定為負責內消旋玉米黃素生成的酶,未來研究可進一步闡明這種黃斑特有類胡蘿蔔素的生理作用。
材料與方法
總RNA分離與RNA測序
使用Qiagen RNeasy試劑盒從E16和E21雞胚胎中分離總RNA。從總RNA樣本(100–500納克)中純化完整的poly(A) RNA,使用寡聚(dT)磁珠,並使用Illumina TruSeq Stranded mRNA Library Preparation Kit製備鏈式mRNA測序文庫。詳情見SI材料與方法。
細胞培養與暫態轉染
建立了E21雞RPE的原代細胞培養,並對HEK293T細胞進行RPE65或GFP的暫態轉染以進行過表達實驗,詳情見SI材料與方法。
類胡蘿蔔素處理
製備HPLC純化的類胡蘿蔔素儲備。在乾燥的儲備中加入Tween 40,然後加入培養基。以含類胡蘿蔔素的培養基處理細胞0、1、2或4天。詳情見SI材料與方法。
類胡蘿蔔素提取與HPLC分析
按照先前描述的方法(10)及SI材料與方法進行類胡蘿蔔素提取和手性HPLC分析。
蛋白質分離與西方墨點分析
按照標準協議進行細胞裂解、蛋白質分離和西方墨點分析,詳情見SI材料與方法。
雞胚胎的抑制劑處理
在E17和E19時將適當濃度的ACU-5200(Acucela Inc.)稀釋於含1%青黴素-鏈黴素的Ringer溶液中,注射到雞胚胎中(SI材料與方法)。
葉黃素對接到RPE65的結構建模
使用Phyre2(40)構建雞RPE65的同源模型,將雞序列嵌入牛RPE65結構(PDB ID代碼4RSC和3FSN)(29, 41)。詳情見SI材料與方法。
SI材料與方法
RNA測序
純化的文庫在Agilent 2200 TapeStation上使用D1000 ScreenTape試劑(目錄號5067–5582和5067–5583)進行質量檢驗。使用Kapa Library Quant Kit(Kapa Biosystems;目錄號KK4824)通過定量PCR確定適配器修飾分子的摩爾濃度。單獨文庫標準化至10 nM,並等量混合以進行Illumina序列分析。讀數使用Novoalign比對至galGal4基因組及所有可能的剪接位點。剪接比對使用USeq的SamTranscriptomeParser轉回基因組空間。此應用程式還移除低質量讀數並將sam格式文件轉換為bam格式。使用USeq Sam2USeq和USeq2UCSC應用程式生成標準化覆蓋軌跡。使用USeq的DefinedRegionDifferentialSeq確定差異表達,該方法使用DESeq2統計包。數據使用自定義R腳本進行聚類。顯著基因使用Qiagen Ingenuity Pathway Analysis軟件分析。僅分析log2比率>1的基因。
細胞培養與暫態轉染
從E21雞胚胎中移除眼睛,借助胰蛋白酶分離RPE/脈絡膜。釋放的RPE細胞小心地接種於Corning Primaria組織培養瓶(Thermo Fisher Scientific)中,然後在含20% FBS和1%抗生素-抗真菌混合物的DMEM中培養。5天後移除此培養基,加入含10% FBS的DMEM。細胞達到融合時,使用TrypLE Express(Thermo Fisher Scientific)進行傳代並接種於T-25瓶中。實驗使用P5細胞。HEK-293T人類胚胎腎細胞系(American Type Culture Collection)在含10% FBS和1%抗生素混合物(Thermo Fisher Scientific)的DMEM中培養。過表達通過暫態轉染pCDNA3.1雞RPE65、pCDNA3.1人類RPE65(均由Jian-Xing Ma慷慨提供)或pCDNA3.1 GFP(OriGene)質粒進行。使用jetPRIME試劑(Polyplus Transfection)按製造商說明進行轉染。
類胡蘿蔔素處理
HPLC純化的葉黃素由Kemin Health提供,玉米黃素由Zeavision提供,內消旋玉米黃素由DSM提供。類胡蘿蔔素儲備在己烷中製備。向適量儲備中加入0.3% Tween 40(Sigma-Aldrich),並在氮氣下乾燥。向此混合物中加入完全培養基,該溶液在冰上超聲處理30分鐘,然後在室溫下渦旋20分鐘。含類胡蘿蔔素的培養基加入細胞以啟動類胡蘿蔔素攝取。培養皿置於37°C培養箱中0、1、2或4天。隨後用冰冷的10 mM牛磺酸鈉洗滌細胞以去除吸附的類胡蘿蔔素,然後用1× PBS洗滌。細胞在1× PBS中刮下並以16,200 × g離心5分鐘,去除多餘液體,進行類胡蘿蔔素提取。
類胡蘿蔔素提取與HPLC分析
在添加含0.1%丁基羥基甲苯的四氫呋喃(THF)後進行類胡蘿蔔素提取。向上述細胞團中加入1 mL THF,該混合物在冰上超聲處理10分鐘,然後渦旋5分鐘。細胞勻漿以最大速度離心10分鐘,取出含類胡蘿蔔素的上清液並在氮氣下乾燥。上述過程重複三次以去除細胞中所有類胡蘿蔔素含量。
蛋白質分離與西方墨點分析
細胞和組織在4°C下於含蛋白酶抑制劑的RIPA緩衝液(25 mM NaCl,0.5 mM EDTA,25 mM Tris⋅HCl pH 7.2,0.1% Tween 20)中勻漿。通過離心去除細胞碎片。進行BCA試驗(Thermo Fisher Scientific),並以9% SDS/PAGE解析20微克蛋白質。使用Trans-Blot SD半乾式轉移儀(Bio-Rad)以25 V轉移至0.45微米硝酸纖維素膜1小時。膜隨後在含0.01% Tween 20的TBS中洗滌,然後在含0.01% Tween 20的Odyssey Blocking Buffer(LI-COR)中封閉1小時。主要抗體在上述封閉緩衝液中稀釋,膜在4°C下孵育過夜。使用的抗體及其稀釋度如下:1:1,000稀釋的DALEED雞RPE65抗體,1:1,000稀釋的PETLET人類RPE65抗體(均由Jian-Xing Ma慷慨提供)和1:5,000稀釋的小鼠單克隆β-肌動蛋白抗體(8H10D10;Cell Signaling Technology)。在含1:10,000稀釋的IR染料共軛二抗(LI-COR)在室溫下孵育1小時後,使用Odyssey Image Analyzer(LI-COR)可視化蛋白質。
雞胚胎的抑制劑處理
蛋殼以70%乙醇擦拭並側放,以精確定位卵黃囊。每個蛋的側面用電工膠帶固定,並使用無菌18號針頭通過膠帶製作小孔。然後使用21號針頭將0.1 mL Ringer溶液或含ACU-5200的Ringer溶液引入發育中胚胎的卵黃囊。注射部位用電工膠帶封蓋,蛋以注射部位朝上孵育。
葉黃素的剛體對接
使用Phyre2(40)構建雞酶的同源模型,將雞序列嵌入牛結構(PDB ID代碼3FSN)。雞和牛酶共享89%身份,無插入或缺失。所有變異位置均被排除在底物結合隧道狀腔體之外。從植物光系統結構(PDB ID代碼1RWT、3JCU、3PL9和4XK8)中收集與葉綠素結合蛋白複合的葉黃素結構。RPE65抑制劑複合結構(PDB ID代碼4RSC)中的emixustat和棕櫚酸位置提供了初始導向坐標,通過手動識別符合立體要求(非氫原子距離>3.5Å)的附近位置進行增補。通過多個不同葉黃素結構的最小二乘疊加,選擇多個立體可接受的坐標並與ε-紫羅酮環和聚烯鏈中的原子配對,共獲得33,738次對接試驗。通過計算立體衝突數量(非氫原子間距離<3Å)和潛在氫鍵(電負性原子間距離2.0–4.2Å)對對接複合物進行評分,使用由M.P.H.編寫的C語言計算機程序(42)。
本文翻譯自論文
Shyam R, Gorusupudi A, Nelson K, Bernstein PS. RPE65 has an additional function as the lutein to meso-zeaxanthin isomerase in the vertebrate eye. Proc Natl Acad Sci U S A. 2017;114(41):10882-10887. doi:10.1073/pnas.1706332114
參考文獻
CC Huang, EC Meng, JH Morris, EF Pettersen, TE Ferrin, Enhancing UCSF Chimera through web services. Nucleic Acids Res 42, W478–W484 (2014).
T Maoka, A Arai, M Shimizu, T Matsuno, The first isolation of enantiomeric and meso-zeaxanthin in nature. Comp Biochem Physiol B 83, 121–124 (1986).
PS Bernstein, et al., Lutein, zeaxanthin, and meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Prog Retin Eye Res 50, 34–66 (2016).
B Li, P Vachali, PS Bernstein, Human ocular carotenoid-binding proteins. Photochem Photobiol Sci 9, 1418–1425 (2010).
M Katsuyama, T Komori, T Matsuno, Metabolism of three stereoisomers of astaxanthin in the fish, rainbow trout and tilapia. Comp Biochem Physiol B 86, 1–5 (1987).
JM Nolan, et al., Verification of meso-zeaxanthin in fish. J Food Process Technol 5, 335 (2014).
EY Chew, et al., Secondary analyses of the effects of lutein/zeaxanthin on age-related macular degeneration progression: AREDS2 report no. 3. JAMA Ophthalmol; Age-Related Eye Disease Study 2 (AREDS2) Research Group 132, 142–149 (2014).
P Bhosale, B Serban, DY Zhao, PS Bernstein, Identification and metabolic transformations of carotenoids in ocular tissues of the Japanese quail Coturnix japonica. Biochemistry 46, 9050–9057 (2007).
EJ Johnson, M Neuringer, RM Russell, W Schalch, DM Snodderly, Nutritional manipulation of primate retinas, III: Effects of lutein or zeaxanthin supplementation on adipose tissue and retina of xanthophyll-free monkeys. Invest Ophthalmol Vis Sci 46, 692–702 (2005).
RA Bone, JT Landrum, GW Hime, A Cains, J Zamor, Stereochemistry of the human macular carotenoids. Invest Ophthalmol Vis Sci 34, 2033–2040 (1993).
A Gorusupudi, et al., Developmentally regulated production of meso-zeaxanthin in chicken retinal pigment epithelium/choroid and retina. Invest Ophthalmol Vis Sci 57, 1853–1861 (2016).
PS Bernstein, WC Law, RR Rando, Isomerization of all-trans-retinoids to 11-cis-retinoids in vitro. Proc Natl Acad Sci USA 84, 1849–1853 (1987).
G Moiseyev, Y Chen, Y Takahashi, BX Wu, J-X Ma, RPE65 is the isomerohydrolase in the retinoid visual cycle. Proc Natl Acad Sci USA 102, 12413–12418 (2005).
M Jin, S Li, WN Moghrabi, H Sun, GH Travis, Rpe65 is the retinoid isomerase in bovine retinal pigment epithelium. Cell 122, 449–459 (2005).
TM Redmond, et al., Mutation of key residues of RPE65 abolishes its enzymatic role as isomerohydrolase in the visual cycle. Proc Natl Acad Sci USA 102, 13658–13663 (2005).
P Bhosale, et al., Identification and characterization of a Pi isoform of glutathione S-transferase (GSTP1) as a zeaxanthin-binding protein in the macula of the human eye. J Biol Chem 279, 49447–49454 (2004).
B Li, P Vachali, JM Frederick, PS Bernstein, Identification of StARD3 as a lutein-binding protein in the macula of the primate retina. Biochemistry 50, 2541–2549 (2011).
K-Q Hu, et al., The biochemical characterization of ferret carotene-9′,10′-monooxygenase catalyzing cleavage of carotenoids in vitro and in vivo. J Biol Chem 281, 19327–19338 (2006).
C Kiefer, et al., Identification and characterization of a mammalian enzyme catalyzing the asymmetric oxidative cleavage of provitamin A. J Biol Chem 276, 14110–14116 (2001).
A Wyss, et al., Expression pattern and localization of β,β-carotene 15,15′-dioxygenase in different tissues. Biochem J 354, 521–529 (2001).
TM Redmond, et al., Identification, expression, and substrate specificity of a mammalian β-carotene 15,15′-dioxygenase. J Biol Chem 276, 6560–6565 (2001).
R Kawaguchi, et al., A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science 315, 820–825 (2007).
JJ Kaylor, et al., Identification of DES1 as a vitamin A isomerase in Müller glial cells of the retina. Nat Chem Biol 9, 30–36 (2013).
P Borel, et al., CD36 and SR-BI are involved in cellular uptake of provitamin A carotenoids by Caco-2 and HEK cells, and some of their genetic variants are associated with plasma concentrations of these micronutrients in humans. J Nutr 143, 448–456 (2013).
JM Enright, et al., Cyp27c1 red-shifts the spectral sensitivity of photoreceptors by converting vitamin A1 into A2. Curr Biol 25, 3048–3057 (2015).
G Moiseyev, Y Takahashi, Y Chen, S Kim, J-X Ma, RPE65 from cone-dominant chicken is a more efficient isomerohydrolase compared with that from rod-dominant species. J Biol Chem 283, 8110–8117 (2008).
CP Hamel, et al., Molecular cloning and expression of RPE65, a novel retinal pigment epithelium-specific microsomal protein that is post-transcriptionally regulated in vitro. J Biol Chem 268, 15751–15757 (1993).
PU Dugel, et al., Phase II randomized, placebo-controlled, 90-day study of emixustat hydrochloride in geographic atrophy associated with dry age-related macular degeneration. Retina 35, 1173–1183 (2015).
LS Jack, MA Sadiq, DV Do, QD Nguyen, Emixustat and lampalizumab: Potential therapeutic options for geographic atrophy. Dev Ophthalmol 55, 302–309 (2016).
PD Kiser, et al., Catalytic mechanism of a retinoid isomerase essential for vertebrate vision. Nat Chem Biol 11, 409–415 (2015).
B Li, F Ahmed, PS Bernstein, Studies on the singlet oxygen scavenging mechanism of human macular pigment. Arch Biochem Biophys 504, 56–60 (2010).
R Crosby-Nwaobi, P Hykin, T Peto, S Sivaprasad, An exploratory study evaluating the effects of macular carotenoid supplementation in various retinal diseases. Clin Ophthalmol 10, 835–844 (2016).
JM Nolan, et al., Enrichment of macular pigment enhances contrast sensitivity in subjects free of retinal disease: Central retinal enrichment supplementation trials. Report 1. Invest Ophthalmol Vis Sci 57, 3429–3439 (2016).
GJ McKay, et al., Investigation of genetic variation in scavenger receptor class B, member 1 (SCARB1) and association with serum carotenoids. Ophthalmology 120, 1632–1640 (2013).
D Babino, et al., The biochemical basis of vitamin A3 production in arthropod vision. ACS Chem Biol 11, 1049–1057 (2016).
DP Kloer, GE Schulz, Structural and biological aspects of carotenoid cleavage. Cell Mol Life Sci 63, 2291–2303 (2006).
DP Kloer, S Ruch, S Al-Babili, P Beyer, GE Schulz, The structure of a retinal-forming carotenoid oxygenase. Science 308, 267–269 (2005).
X Sui, PD Kiser, Jv Lintig, K Palczewski, Structural basis of carotenoid cleavage: From bacteria to mammals. Arch Biochem Biophys 539, 203–213 (2013).
PP Vachali, BM Besch, F Gonzalez-Fernandez, PS Bernstein, Carotenoids as possible interphotoreceptor retinoid-binding protein (IRBP) ligands: A surface plasmon resonance (SPR)-based study. Arch Biochem Biophys 539, 181–186 (2013).
O Voolstra, et al., The Drosophila class B scavenger receptor NinaD-I is a cell surface receptor mediating carotenoid transport for visual chromophore synthesis. Biochemistry 45, 13429–13437 (2006).
LA Kelley, S Mezulis, CM Yates, MN Wass, MJE Sternberg, The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc 10, 845–858 (2015).
PD Kiser, M Golczak, DT Lodowski, MR Chance, K Palczewski, Crystal structure of native RPE65, the retinoid isomerase of the visual cycle. Proc Natl Acad Sci USA 106, 17325–17330 (2009).
MP Horvath, et al., Structure of the lutein-binding domain of human StARD3 at 1.74 Å resolution and model of a complex with lutein. Acta Crystallogr F Struct Biol Commun 72, 609–618 (2016).
EF Pettersen, et al., UCSF Chimera: A visualization system for exploratory research and analysis. J Comput Chem 25, 1605–1612 (2004).
發表留言